Hình bên là công thức Lewis của H2SO4. Dựa vào công thức Lewis của H2SO4,
Lời giải Bài 7.4 trang 23 SBT Hóa học 11 sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 11.
Giải SBT Hóa học 11 Bài 7: Sulfuric acid và muối sulfate
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4.
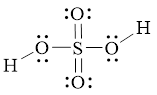
a) Dựa vào công thức Lewis của H2SO4, hãy cho biết số oxi hóa của nguyên tử sulfur trong phân tử.
b) Khi tham gia phản ứng, H2SO4 không thể tạo ra các sản phẩm chứa sulfur có số oxi hóa lớn hơn hoặc bằng 7. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
Lời giải:
a) Do 6 electron hóa trị của S bị lệch về phía các nguyên tử O nên S có số oxi hóa là +6.
b) S chỉ có 6 electron hóa trị nên không thể có số oxi hóa lớn hơn 6.
c) Có do H2SO4 cũng là chất có tính oxi hóa mạnh.
8HI + H2SO4 → H2S + 4I2 + 4H2O
Xem thêm giải Sách bài tập Hóa học 11 bộ sách Cánh diều hay, chi tiết khác:
Bài 7.1 trang 22 SBT Hoá học 11: Những phát biểu nào sau đây là đúng?...
Bài 7.2 trang 23 SBT Hoá học 11: Những đặc điểm nào sau đây về muối sulfate là đúng?...
Bài 7.4 trang 23 SBT Hoá học 11: Hình bên là công thức Lewis của H2SO4...
Xem thêm giải Sách bài tập Hóa học 11 bộ sách Cánh diều hay, chi tiết khác:
Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 3: PH của dung dịch. Chuẩn độ acid – base
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều
