Giáo án điện tử Ôn tập chương 2 | Bài giảng PPT Hóa 11 Kết nối tri thức
Với Giáo án PPT Hóa 11 Bài 9: Ôn tập chương 2 sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Ôn tập chương 2.
Chỉ từ 400k mua trọn bộ Giáo án Hóa 11 Kết nối tri thức bản PPT trình bày khoa học, đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Hóa 11 Bài 9: Ôn tập chương 2

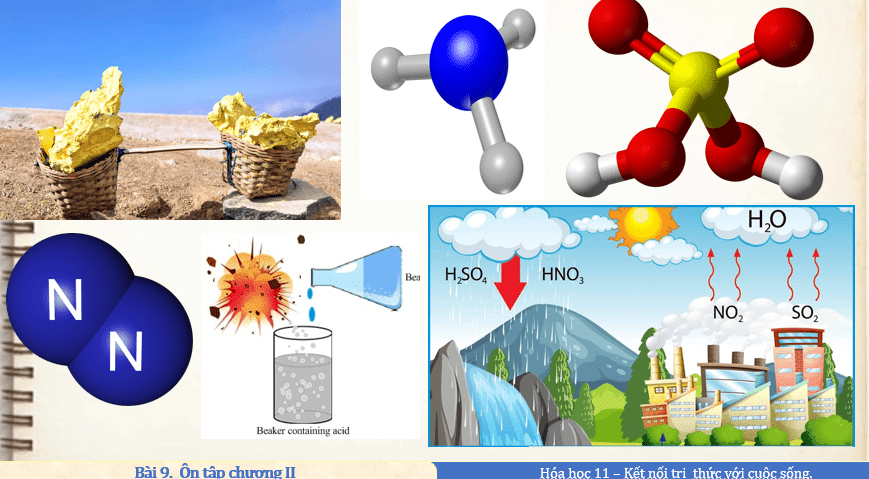








................................................
................................................
................................................
Tài liệu có 20 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT Hóa 11 Kết nối tri thức Bài 9: Ôn tập chương 2.
Giáo án Bài 9: Ôn tập chương 2
A. MỤC TIÊU
1. Kiến thức
- Lập được sơ đồ hệ thống hoá kiến thức đã học ở chương 2.
- Vận dụng lí thuyết đã học giải các dạng bài tập liên quan.
- Vận dụng kiến thức đã học giải quyết các vấn đề liên quan phát sinh trong thực tiễn.
2. Năng lực
a. Năng lực hóa học
- Vận dụng kiến thức kĩ năng đã học lập sơ đồ hệ thống hoá kiến thức đã học ở chương 2. Vận dụng lí thuyết đã học giải các dạng bài tập liên quan.
b. Năng lực chung
- Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu hoàn thành các nhiệm vụ trong quá trình luyện tập.
- Năng lực giao tiếp và hợp tác: Hoạt động nhóm, cặp đôi một cách hiệu quả theo yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia.
- Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học.
3. Phẩm chất
- Chăm chỉ, tự tìm tòi thông tin trong các hoạt động.
- Có trách nhiệm tham gia tích cực hoạt động nhóm và cặp đôi phù hợp với khả năng của bản thân.
- Nhân ái: Có ý thức tôn trọng ý kiến của các thành viên trong nhóm khi hợp tác.
B. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên (GV)
- Làm các slide trình chiếu.
- Phiếu học tập, phiếu giao nhiệm vụ học tập cho các nhóm.
2. Học sinh (HS)
- Chuẩn bị theo các yêu cầu của GV.
- Giấy A0 hoặc bảng hoạt động nhóm.
- Bút mực viết bảng.
C. TIẾN TRÌNH DẠY HỌC
I. HOẠT ĐỘNG KHỞI ĐỘNG (khoảng 5 phút)
a. Mục tiêu: Huy động kiến thức đã học và tạo nhu cầu tìm hiểu kiến thức mới.
b. Nôi dung: Xây dựng sơ đồ tư duy hệ thống hoá kiến thức chương 2.
c. Sản phẩm: Sơ đồ tư duy hệ thống hoá kiến thức chương 2 của từng cá nhân.
d. Tổ chức thực hiện
Chuyển giao nhiệm vụ học tập
GV đã giao nhiệm vụ về nhà: Sử dụng kỹ thuật sơ đồ tư duy để tổng kết những kiến thức cơ bản của chương 2 của từng cá nhân.
GV cho 2 HS cùng bàn để kiểm tra chéo sơ đồ tư duy.
Thực hiện nhiệm vụ:
HS hoàn thành cá nhân sơ đồ tư duy để tổng kết kiến thức của chương 2
- GV dẫn dắt vào bài mới.
II. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1: HỆ THỐNG HOÁ KIẾN THỨC
a. Mục tiêu
- Củng cố cho HS kiến thức về nitrogen, ammonia – muối ammonium, sulfur – sulfur dioxide, sulfuric acid – muối sulfate thông qua việc lập sơ đồ tư duy.
b. Nội dung: Lập sơ đồ hệ thống hoá kiến thức chương 2.
c. Sản phẩm: Sơ đồ tư duy của nhóm HS.
d. Tổ chức thực hiện
*Bước 1: Chuyển giao nhiệm vụ học tập
- GV cho HS hoạt động nhóm (6 HS), chia sẻ, thảo luận để hoàn thành sơ đồ tư duy của nhóm vào bảng A0 (Hoặc trình bày bằng máy tính)
- Giáo viên hướng dẫn, theo dõi, hỗ trợ học sinh khi cần thiết.
*Bước 2: Thực hiện nhiệm vụ học tập
- HS thảo luận nhóm hoàn thành sơ đồ tư duy của nhóm.
*Bước 3: Báo cáo, thảo luận
- Các nhóm cử đại diện trình bày kết quả.
*Bước 4: Kết luận, nhận định
GV nhận xét, đánh giá và chuẩn hóa kiến thức
|
I. HỆ THỐNG HOÁ KIẾN THỨC NITROGEN Nitrogen là nguyên tố phổ biến, góp phần tạo nên sự sống trên Trái Đất. Cấu hình e lớp ngoài cùng của nguyên tử: 2s22p3 Số oxi hoá thường gặp: -3, 0, +1, +2, +3, +4, +5. Phân tử nitrogen gồm hai nguyên tử liên kết với nhau bằng liên kết ba bền vững Đơn chất nitrogen khá trơ ở nhiệt độ thường, hoạt động hoá học mạnh hơn khi đun nóng và có xúc tác. Đơn chất nitrogen thể hiện cả tính oxi hoá và tính khử. AMMONIA – MUỐI AMMONIUM AMMONIA Phân tử ammonia có dạng chóp tam giác, phân tử còn một cặp electron không liên kết. Khí ammonia có mùi khai, dễ tan trong nước, dễ hoá lỏng; ammonia có tính base và tính khử. Ammonia được sản xuất từ nitrogen và hydrogen theo quá trình Haber-Bosch. MUỐI AMMONIUM Muối ammonium thường dễ tan trong nước và kém bền nhiệt. Ion ammonium được nhận biết bằng phản ứng với kiềm, sinh ra khí có mùi khai. SULFUR – SULFUR DIOXIDE SULFUR Sulfur là nguyên tố phổ biến trên Trái Đất, tồn tại ở cả dạng đơn chất và hợp chất. Cấu hình e lớp ngoài cùng của nguyên tử: 3s23p4 Số oxi hoá thường gặp: -2, 0, +4, +6. Phân tử dạng mạch vòng gồm 8 nguyên tử liên kết với nhau (S8) và tương đối bền. Đơn chất sulfur thể hiện cả tính oxi hoá và tính khử. SULFUR DIOXIDE Sulfur dioxide phát thải ra môi trường từ quá trình đốt cháy nhiên liệu (than đá, dầu mỏ), đốt cháy sulfur và khoáng vật sulfide Sulfur dioxide có tính chất của oxide, có tính oxi hoá và tính khử. SULFURIC ACID – MUỐI SULFATE SULFURIC ACID Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh. Dung dịch sulfur acid đặc có tính háo nước, có khả năng gây bỏng, có tính acid mạnh và tính oxi hoá mạnh. Bảo quản, sử dụng sulfur acid đặc phải tuân theo quy tắc đảm bảo an toàn, phòng chống cháy, nổ. Sulfur acid được sản xuất từ các nguyên liệu chính: sulfur, quặng pyrite. MUỐI SULFATE Các muối sulfate có nhiều ứng dụng thực tiễn: ammonium sulfate, barium sulfate, calcium sulfate, magnesium sulfate,… Ion sulfate trong dung dịch được nhận biết bằng ion Ba2+. |
- Đánh giá kết quả của hoạt động
+ Thông qua quan sát: GV chú ý quan sát khi các nhóm thảo luận, kịp thời phát hiện những khó khăn, vướng mắc của HS và có giải pháp hỗ trợ hợp lí.
................................................
................................................
................................................
Xem thử tài liệu tại đây:
Xem thêm các chương trình khác:
- Giáo án Sinh học 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Toán 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Cánh diều (mới nhất)
- Giáo án Hóa 11 Cánh diều (mới nhất)
- Giáo án Vật lí 11 Cánh diều (mới nhất)
- Giáo án PPT Vật lí 11 Cánh diều
- Giáo án PPT Toán 11 Cánh diều
- Giáo án PPT Ngữ văn 11 Cánh diều
- Giáo án Lịch sử 11 Cánh diều (mới nhất)
- Giáo án Địa lí 11 Cánh diều (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Cánh diều (mới nhất)
- Giáo án PPT Sinh học 11 Cánh diều
- Giáo án PPT Hóa 11 Cánh diều
- Giáo án Chuyên đề học tập Hóa 11 Cánh diều (mới nhất)
- Giáo án PPT Địa lí 11 Cánh diều
- Giáo án PPT Lịch sử 11 Cánh diều
- Giáo án PPT Kinh tế pháp luật 11 Cánh diều
- Giáo án Toán 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Chân trời sáng tạo (mới nhất)
- Giáo án Hóa 11 Chân trời sáng tạo (mới nhất)
- Giáo án Vật lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Vật lí 11 Chân trời sáng tạo
- Giáo án PPT Toán 11 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 11 Chân trời sáng tạo
- Giáo án PPT Hóa 11 Chân trời sáng tạo
- Giáo án Lịch sử 11 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 11 Chân trời sáng tạo
- Giáo án PPT Địa lí 11 Chân trời sáng tạo
- Giáo án PPT Sinh học 11 Chân trời sáng tạo
- Giáo án Sinh học 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án PPT Kinh tế pháp luật 11 Chân trời sáng tạo
