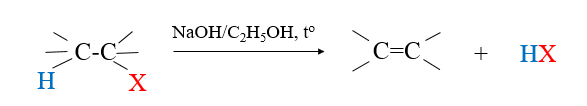Giáo án điện tử Dẫn xuất halogen | Bài giảng PPT Hóa 11 Kết nối tri thức
Với Giáo án PPT Hóa 11 Bài 19: Dẫn xuất halogen sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Dẫn xuất halogen.
Chỉ từ 400k mua trọn bộ Giáo án Hóa 11 Kết nối tri thức bản PPT trình bày khoa học, đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Hóa 11 Bài 19: Dẫn xuất halogen

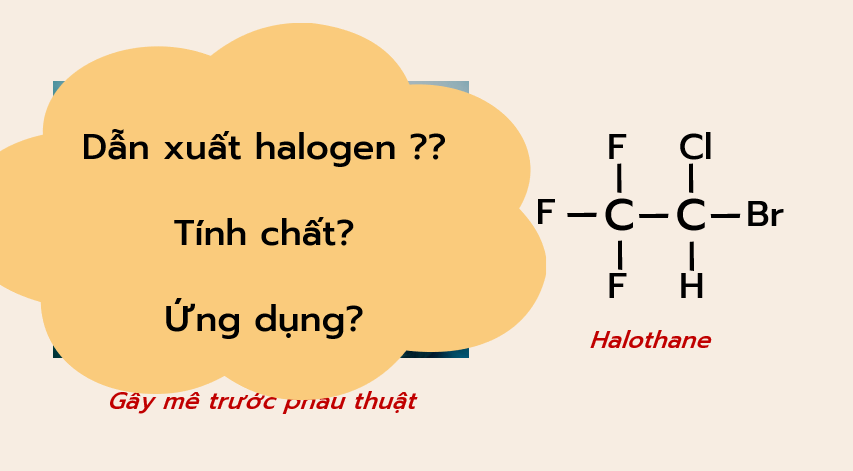




................................................
................................................
................................................
Tài liệu có 24 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT Hóa 11 Kết nối tri thức Bài 19: Dẫn xuất halogen.
Giáo án Bài 19: Dẫn xuất halogen
I. MỤC TIÊU
1. Kiến thức
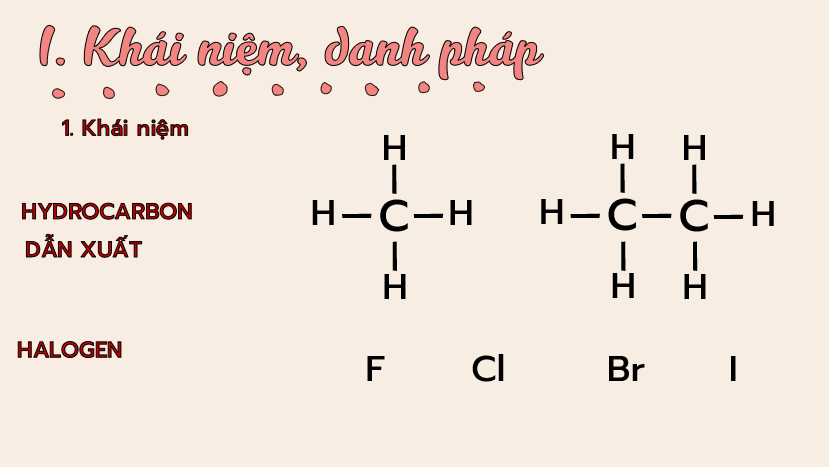
– Trình bày được khái niệm dẫn xuất halogen.
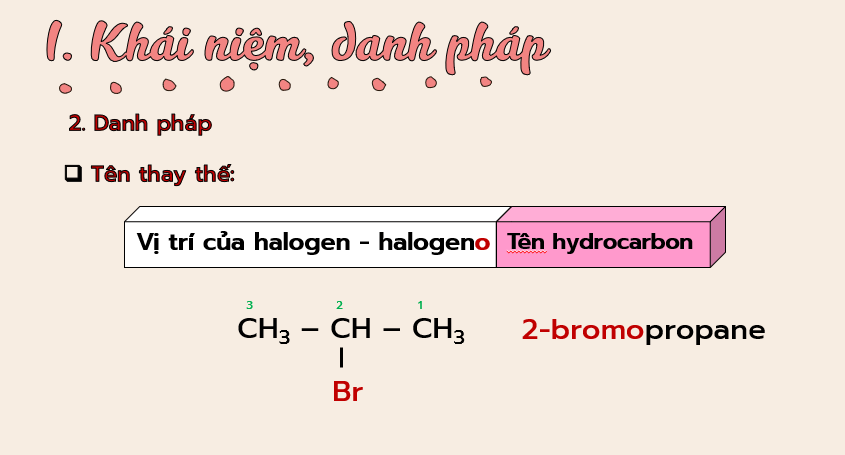
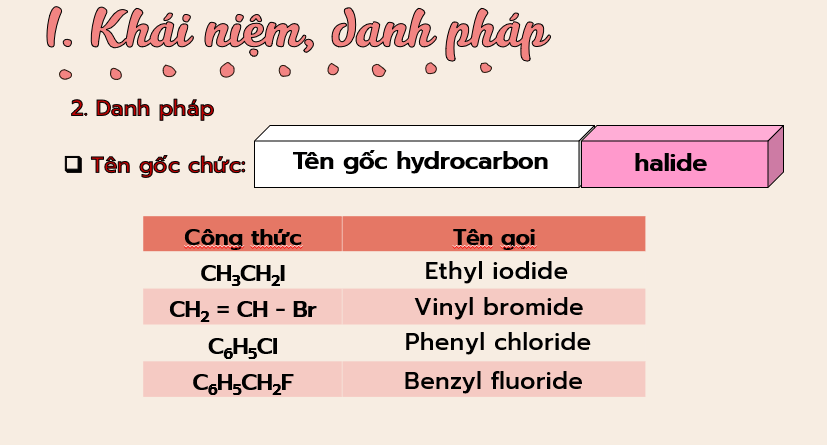
– Viết được công thức cấu tạo, gọi được tên theo danh pháp thay thế (C1 – C5) và danh pháp thường của một vài dẫn xuất halogen thường gặp.
– Trình bày được đặc điểm về tính chất vật lí của một số dẫn xuất halogen.
– Trình bày được tính chất hoá học cơ bản của dẫn xuất halogen: Phản ứng thế nguyên tử halogen (với OH–); Phản ứng tách hydrogen halide theo quy tắc Zaisev.
– Thực hiện được (hoặc quan sát video) thí nghiệm thuỷ phân ethyl bromide (hoặc ethyl chloride); mô tả được các hiện tượng thí nghiệm, giải thích được tính chất hoá học của dẫn xuất halogen.
– Trình bày được ứng dụng của các dẫn xuất halogen; tác hại của việc sử dụng các hợp chất chlorofluorocarbon (CFC) trong công nghệ làm lạnh. Đưa ra được cách ứng xử thích hợp đối với việc lạm dụng các dẫn xuất halogen trong đời sống và sản xuất (thuốc trừ sâu, thuốc diệt cỏ, chất kích thích tăng trưởng thực vật...)
2. Năng lực:
2.1. Năng lực chung:
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình ảnh, kĩ năng thực hành thí nghiệm để tìm hiểu về tính chất của dẫn xuất halogen.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về tính chất, ứng dụng của dẫn xuất halogen, trình bày và báo cáo trước lớp
- Năng lực giải quyết vấn đề và sáng tạo: Đưa ra được cách ứng xử thích hợp đối với việc lạm dụng các dẫn xuất halogen trong đời sống và sản xuất (thuốc trừ sâu, thuốc diệt cỏ, chất kích thích tăng trưởng thực vật...).
2.2. Năng lực hóa học:
a. Nhận thức hoá học:
– Trình bày được khái niệm dẫn xuất halogen.
– Viết được công thức cấu tạo, gọi được tên theo danh pháp thay thế (C1 – C5) và danh pháp thường của một vài dẫn xuất halogen thường gặp.
– Nêu được đặc điểm về tính chất vật lí của một số dẫn xuất halogen.
– Trình bày được tính chất hoá học cơ bản của dẫn xuất halogen: Phản ứng thế nguyên tử halogen (với OH–); Phản ứng tách hydrogen halide theo quy tắc Zaisev.
b. Tìm hiểu tự nhiên dưới góc độ hóa học
- Tìm hiểu tác động của CFC đến tầng ozone và một số loại thuốc trừ sâu có ảnh hưởng đến môi trường và sức khỏe con người
c. Vận dụng kiến thức, kĩ năng đã học
Trình bày được ứng dụng của các dẫn xuất halogen; tác hại của việc sử dụng các hợp chất chlorofluorocarbon (CFC) trong công nghệ làm lạnh. Đưa ra được cách ứng xử thích hợp đối với việc lạm dụng các dẫn xuất halogen trong đời sống và sản xuất (thuốc trừ sâu, thuốc diệt cỏ, chất kích thích tăng trưởng thực vật...).
3. Phẩm chất:
- Chăm chỉ, tự tìm tòi thông tin trong SGK và các tài liệu khác liên quan đến dẫn xuất halogen.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
- HS có trách nhiệm trong cộng đồng, nâng cao ý thức bảo vệ môi trường.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hình ảnh về ứng dụng của một số dẫn xuất halogen, video phản ứng thủy phân bromoethane.
- Phiếu học tập 1,2,3
|
Phiếu học tập số 1 Tìm hiểu khái niệm SGK Hóa học 11, trang 112 và cho biết: 1. Khái niệm dẫn xuất halogen là gì? CTTQ của dẫn xuất halogen? 2. Cách gọi tên dẫn xuất halogen theo danh pháp thay thế? - Gọi tên theo danh pháp thay thế các dẫn xuất halogen sau: CH3CH2Br; CH3CHICH3; CH2=CHCl; C6H5F - Áp dụng viết CTCT của dẫn xuất halogen có CTPT C4H9Cl và gọi tên theo danh pháp thay thế? 3. Điền vào bảng sau:
3. Tìm hiểu và gọi tên thông thường của một số dẫn xuất halogen sau:
|
|
Phiếu học tập số 2 - Nghiên cứu phản ứng thủy phân bromoethane 1. Thực hiện thí nghiệm: - Cho khoảng 1 mL bromoethane (C2H5Br) vào ống nghiệm (1), thêm khoảng 3 mL nước cất rồi lắc đều. Để hỗn hợp tách thành 2 lớp, lấy lớp trên của hỗn hợp nhỏ vào ống nghiệm có chứa sẵn 1 mL dung dịch AgNO3. Nếu thấy có kết tủa, lặp lại đến khi không còn kết tủa (nước rửa không còn ion halogen) - Thêm 2 mL dung dịch NaOH 10% vào ống nghiệm (1), lắc nhẹ ống nghiệm rồi ngâm vào cốc nước nóng khoảng 5 phút, thỉnh thoảng lắc đều ống nghiệm, để nguội rồi lấy khoảng 1 mL chất lỏng ở phần trên ống nghiệm (1) và chuyển sang ống nghiệm (2) - Trung hòa base dư ở ống nghiệm (2) bằng dung dịch HNO3 (thử bằng giấy chỉ thị pH) rồi nhỏ thêm vài giọt dung dịch AgNO3 1%, quan sát thấy có kết tủa vàng nhạt xuất hiện . 2. Trả lời câu hỏi và thực hiện yêu cầu sau: - Tại sao hỗn hợp ban đầu lại tách thành 2 lớp, bromoethane nằm ở lớp nào? - Kết tủa xuất hiện ở ống nghiệm (2) sau khi thêm AgNO3 vào là chất gì? Tại sao cần phải trung hòa dung dịch base dư trước khi cho dung dịch AgNO3 1% vào ống nghiệm (2) - Dự đoán sản phẩm và viết phương trình hóa học của các phản ứng xảy ra trong quá trình thí nghiệm. - Bezyl alcohol là một hợp chất có tác dụng kháng khuẩn, chống vi sinh vật kí sinh trên da (chấy, rận...) nên được sử dụng rộng rãi trong mĩ phẩm, dược phẩm. Benzyl alcohol thu được khi thủy phân bezyl chloride trong môi trường kiềm. Hãy xác định công thức của benzyl alcohol. C6H5-CH2Cl + NaOH à Benzyl alcohol + NaCl Nghiên cứu phản ứng tách hydrogen halide - Các dẫn xuất monohalogen của alkane có thể bị tách hydrogen halide tạo thành alkene theo sơ đồ sau: Hãy viết pthh xảy ra khi thực đung nóng lần lượt các chất CH3-CH2-Br; CH3CHClCH3 với NaOH trong dung môi ethanol. Nghiên cứu quy tắc tách Zaitsev (SGK Hóa học 11- KNTT trang 116), hãy xác viết pthh và định sản phẩm chính, sản phẩm phụ khi thực hiện phản ứng tách hydrogen halide bằng cách đun nóng các chất CH3-CHBr-CH2-CH3; CH3- BrC(CH3)-CH2-CH3 với NaOH trong dung môi ethanol. |
................................................
................................................
................................................
Xem thử tài liệu tại đây:
Xem thêm các chương trình khác:
- Giáo án Sinh học 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Toán 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Cánh diều (mới nhất)
- Giáo án Hóa 11 Cánh diều (mới nhất)
- Giáo án Vật lí 11 Cánh diều (mới nhất)
- Giáo án PPT Vật lí 11 Cánh diều
- Giáo án PPT Toán 11 Cánh diều
- Giáo án PPT Ngữ văn 11 Cánh diều
- Giáo án Lịch sử 11 Cánh diều (mới nhất)
- Giáo án Địa lí 11 Cánh diều (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Cánh diều (mới nhất)
- Giáo án PPT Sinh học 11 Cánh diều
- Giáo án PPT Hóa 11 Cánh diều
- Giáo án Chuyên đề học tập Hóa 11 Cánh diều (mới nhất)
- Giáo án PPT Địa lí 11 Cánh diều
- Giáo án PPT Lịch sử 11 Cánh diều
- Giáo án PPT Kinh tế pháp luật 11 Cánh diều
- Giáo án Toán 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Chân trời sáng tạo (mới nhất)
- Giáo án Hóa 11 Chân trời sáng tạo (mới nhất)
- Giáo án Vật lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Vật lí 11 Chân trời sáng tạo
- Giáo án PPT Toán 11 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 11 Chân trời sáng tạo
- Giáo án PPT Hóa 11 Chân trời sáng tạo
- Giáo án Lịch sử 11 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 11 Chân trời sáng tạo
- Giáo án PPT Địa lí 11 Chân trời sáng tạo
- Giáo án PPT Sinh học 11 Chân trời sáng tạo
- Giáo án Sinh học 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án PPT Kinh tế pháp luật 11 Chân trời sáng tạo