Giáo án điện tử Cân bằng trong dung dịch nước | Bài giảng PPT Hóa 11 Kết nối tri thức
Với Giáo án PPT Hóa 11 Bài 2: Cân bằng trong dung dịch nước sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Cân bằng trong dung dịch nước.
Chỉ từ 400k mua trọn bộ Giáo án Hóa 11 Kết nối tri thức bản PPT trình bày khoa học, đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Hóa 11 Bài 2: Cân bằng trong dung dịch nước








................................................
................................................
................................................
Tài liệu có 97 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT Hóa 11 Kết nối tri thức Bài 2: Cân bằng trong dung dịch nước.
Giáo án Bài 2: Cân bằng trong dung dịch nước
I. Mục tiêu
1) Kiến thức
- Nêu được khái niệm sự điện li, chất điện li, chất không điện li.
- Trình bày được thuyết Brϕnsted – Lowry về acid – base.
- Nêu được khái niệm và ý nghĩa của pH trong thực tiễn.
- Viết được biểu thức tính pH và biết cách sử dụng các chất chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như chất chỉ thị màu, quỳ tím, phenolphthalein, …
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid – base; chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+; Fe3+ và CO2−3.
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: Học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: nêu được khái niệm sự điện li, chất điện li, chất không điện li, thuyết Brϕnsted – Lowry về acid – base, khái niệm pH …
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: nêu được ý nghĩa của pH trong thực tiễn, liên hệ giá trị pH ở các bộ phận trong cơ thể với sức khoẻ con người, pH của đất, nước, tới sự phát triển của động, thực vật, ….
- Năng lực vận dụng kiến thức, kỹ năng đã học: sử dụng các chất chỉ thị để xác định pH của các dung dịch, thực hiện được thí nghiệm chuẩn độ acid – base …
3) Phẩm chất
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- 6 bộ dụng cụ, hoá chất thí nghiệm tìm hiểu về sự điện li (cho 6 nhóm).
- 6 bộ dụng cụ cho thí nghiệm làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím.
- 6 bộ dụng cụ, hoá chất cho thí nghiệm chuẩn độ acid, base.
- Giấy chỉ thị, máy đo pH.
- Thiết kế phiếu học tập, slide, máy tính, máy chiếu …
2. Học sinh
- Các nhóm HS chủ động phân công thành viên mang: hoa đậu biếc/ bắp cải tím; cốc nhựa; băng dính, giấy note (để dán nhãn cốc nhựa); giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
- SGK, vở ghi …
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung:
HS thảo luận theo cặp đôi, trả lời câu hỏi mở đầu, từ đó hình thành mục tiêu học tập.
CÂU HỎI MỞ ĐẦU
Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?

c. Sản phẩm:
Câu trả lởi của HS, dự kiến:
pH là một đại lượng liên hệ trực tiếp với nồng độ H+ để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, trả lời câu hỏi mở đầu.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận theo cặp đôi trả lời câu hỏi.
- GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện 1 HS trả lời, các HS còn lại chú ý lắng nghe, nhận xét (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- Câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng/ sai mà căn cứ vào đó để dẫn dắt vào bài mới.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu sự điện li
a) Mục tiêu:
Nêu được khái niệm sự điện li.
b) Nội dung:
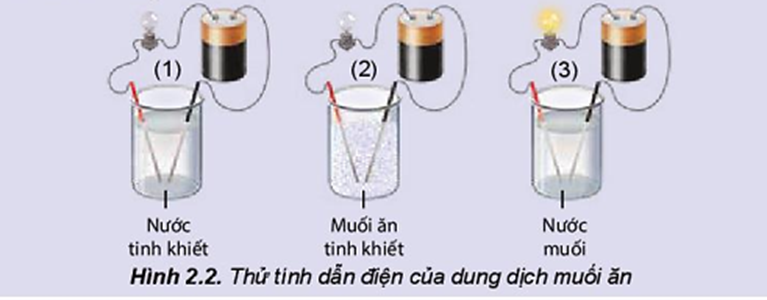
HS làm việc theo nhóm, thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn, từ đó hoàn thành các câu hỏi ở phiếu học tập 1, lĩnh hội kiến thức.
PHIẾU HỌC TẬP SỐ 1
Lắp bộ dụng cụ thí nghiệm như mô tả ảnh sau và trả lời các câu hỏi bên dưới:
Câu 1. Hãy nhắc lại khái niệm dòng điện.
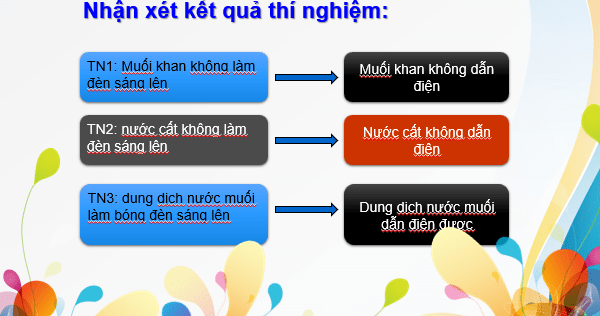
Câu 2. Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)?
Câu 3. Hãy giải thích sự tạo thành các hạt mang điện đó.
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1: Dòng điện là dòng dịch chuyển có hướng của các hạt mang điện.
Câu 2: Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là cation và anion.
Câu 3:
Giải thích:
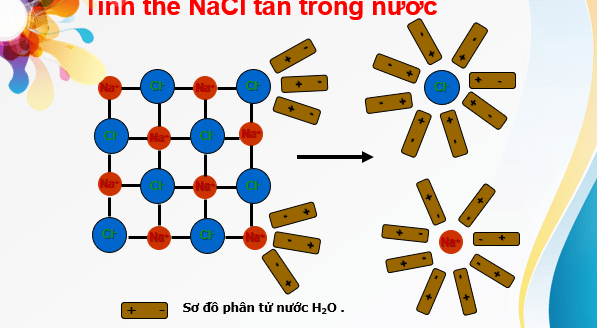
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và Cl- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp làm 6 nhóm, yêu cầu các nhóm thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn như mô tả trong SGK hoặc phiếu học tập số 1, sau đó trả lời các câu hỏi có trong phiếu học tập. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm thực hiện thí nghiệm và hoàn thiện các câu hỏi trong phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận, các HS còn lại theo dõi và nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức, từ đó dẫn dắt vào khái niệm sự điện li. |
I. Sự điện li 1. Hiện tượng điện li Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra ion được gọi là các chất điện li. |
Hoạt động 3: Tìm hiểu chất điện li
a) Mục tiêu:
- Nêu được khái niệm chất điện li và chất không điện li.
b) Nội dung:
................................................
................................................
................................................
Xem thử tài liệu tại đây:
Xem thêm các chương trình khác:
- Giáo án Sinh học 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Toán 11 Cánh diều năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Cánh diều (mới nhất)
- Giáo án Hóa 11 Cánh diều (mới nhất)
- Giáo án Vật lí 11 Cánh diều (mới nhất)
- Giáo án PPT Vật lí 11 Cánh diều
- Giáo án PPT Toán 11 Cánh diều
- Giáo án PPT Ngữ văn 11 Cánh diều
- Giáo án Lịch sử 11 Cánh diều (mới nhất)
- Giáo án Địa lí 11 Cánh diều (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Cánh diều (mới nhất)
- Giáo án PPT Sinh học 11 Cánh diều
- Giáo án PPT Hóa 11 Cánh diều
- Giáo án Chuyên đề học tập Hóa 11 Cánh diều (mới nhất)
- Giáo án PPT Địa lí 11 Cánh diều
- Giáo án PPT Lịch sử 11 Cánh diều
- Giáo án PPT Kinh tế pháp luật 11 Cánh diều
- Giáo án Toán 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Ngữ văn 11 Chân trời sáng tạo (mới nhất)
- Giáo án Hóa 11 Chân trời sáng tạo (mới nhất)
- Giáo án Vật lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Vật lí 11 Chân trời sáng tạo
- Giáo án PPT Toán 11 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 11 Chân trời sáng tạo
- Giáo án PPT Hóa 11 Chân trời sáng tạo
- Giáo án Lịch sử 11 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án Chuyên đề học tập Địa lí 11 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 11 Chân trời sáng tạo
- Giáo án PPT Địa lí 11 Chân trời sáng tạo
- Giáo án PPT Sinh học 11 Chân trời sáng tạo
- Giáo án Sinh học 11 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án PPT Kinh tế pháp luật 11 Chân trời sáng tạo
