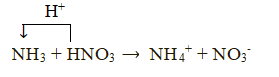Giải Hóa 11 trang 24 Chân trời sáng tạo
Với giải bài tập Hóa học lớp 11 trang 24 trong Bài 4: Ammonia và một số hợp chất ammonium sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 trang 24.
Giải Hóa 11 trang 24 Chân trời sáng tạo
Lời giải:
- Tính chất vật lí của ammonia: chất khí, không màu, mùi khai, xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước.
- Tính chất hoá học: Ammonia thể hiện tính khử và tính base trong các phản ứng hoá học.
Ví dụ:
+ Tính khử: 2-3NH3+3+2CuO→30Cu+0N2+3H2O
+ Tính base:
- Ứng dụng của ammonia: Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
1. Cấu tạo phân tử của ammonia
Lời giải:
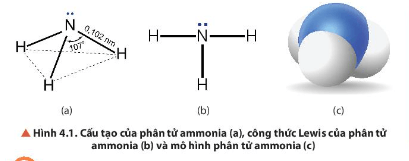
- Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
- Do có thể tạo được liên kết hydrogen với nước nên ammonia tan rất nhiều trong nước.
- Trong phân tử NH3, nitrogen có số oxi hoá là -3, đây là số oxi hoá thấp nhất của nitrogen nên NH3 có tính khử khi tham gia phản ứng hoá học.
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
Mở đầu trang 24 Hóa học 11: Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng
Câu hỏi thảo luận 1 trang 24 Hóa học 11: Quan sát Hình 4.1, mô tả cấu tạo của phân tử ammonia.
Câu hỏi thảo luận 2 trang 25 Hóa học 11: Quan sát Hình 4.2, giải thích hiện tượng thí nghiệm
Câu hỏi thảo luận 4 trang 25 Hóa học 11: Từ sự kết hợp giữa NH3 với nước, nhận xét tính acid – base
Bài 1 trang 29 Hóa học 11: Liên kết hoá học trong phân tử NH3 là liên kết
Bài 4 trang 29 Hóa học 11: Cho cân bằng hoá học:
Bài 5 trang 29 Hóa học 11: Viết phương trình hoá học
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 11 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 11 - Chân trời sáng tạo
- Giải SBT Ngữ văn 11 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 11 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Chân trời sáng tạo
- Soạn văn 11 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 11 – Chân trời sáng tạo
- Lý thuyết Toán 11 - Chân trời sáng tạo
- Giải sbt Toán 11 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 11 – Friends Global
- Giải sbt Tiếng Anh 11 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh 11 Friends Global đầy đủ nhất
- Bài tập Tiếng Anh 11 Friends Global theo Unit có đáp án
- Giải sgk Vật lí 11 – Chân trời sáng tạo
- Lý thuyết Vật lí 11 – Chân trời sáng tạo
- Giải sbt Vật lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 11 – Chân trời sáng tạo
- Giải sgk Sinh học 11 – Chân trời sáng tạo
- Lý thuyết Sinh học 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 11 – Chân trời sáng tạo
- Giải sbt Sinh học 11 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Chân trời sáng tạo
- Lý thuyết Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sgk Lịch sử 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 11 – Chân trời sáng tạo
- Lý thuyết Lịch sử 11 - Chân trời sáng tạo
- Giải sbt Lịch sử 11 – Chân trời sáng tạo
- Giải sgk Địa lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 11 – Chân trời sáng tạo
- Lý thuyết Địa lí 11 - Chân trời sáng tạo
- Giải sbt Địa lí 11 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 11 – Chân trời sáng tạo