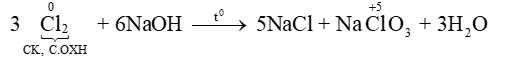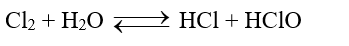Chuyên đề Nguyên tố nhóm VIIA – nhóm Halogen | Chuyên đề dạy thêm Hoá học 10
Tài liệu Chuyên đề Nguyên tố nhóm VIIA – nhóm Halogen gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 10.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 10 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
A. PHẦN LÍ THUYẾT
I. LÍ THUYẾT TRỌNG TÂM BÀI 8: TÍNH CHẤT VẬT LÍ VÀ HÓA HỌC CÁC ĐƠN CHẤT NHÓM VIIA
1. Vị trí, cấu hình electron nguyên tử và đặc điểm cấu tạo phân tử
Một số đặc điểm của các nguyên tố nhóm VIIA (nhóm halogen)
|
Nguyên tố |
Số hiệu nguyên tử |
Cấu hình electron |
Độ âm điện |
Nguyên tử khối |
|
Fluorine (F) |
9 |
[He]2s22p5 |
3,98 |
19 |
|
Chlorine (Cl) |
17 |
[Ne]3s23p5 |
3,16 |
35,5 |
|
Bromine (Br) |
35 |
[Ar]3d104s24p5 |
2,96 |
80 |
|
Iodine (I) |
53 |
[Kr]4d105s25p5 |
2,66 |
127 |
|
Astatine (At) |
85 |
[Xe]4f145d106s26p5 |
2,20 |
210 |
|
Tennessine (Ts) |
117 |
[Rn]5f146d107s27p5 |
– |
294 |
- Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron lớp ngoài cùng dạng ns2np5. Vì vậy, chúng là các phi kim.
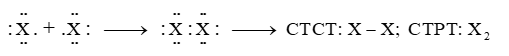
- Do có 7 electron ở lớp ngoài cùng, chưa đạt cấu hình bền vững như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử.
2. Tính chất vật lí
Một số tính chất vật lí của đơn chất halogen
|
Đơn chất |
Trạng thái |
Màu sắc |
tnc (℃) |
ts (℃) |
Độ tan trong nước (mol/L) (ở ℃) |
|
F2 |
Khí |
Vàng nhạt |
–219,6 |
–188,1 |
– |
|
Cl2 |
Khí |
Vàng lục |
–101,0 |
–34,1 |
0,091 |
|
Br2 |
Lỏng |
Nâu đỏ |
–7,3 |
59,2 |
0,21 |
|
I2 |
Rắn |
Tím đen |
113,6 |
185,5 |
0,0013 |
- Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Walls giữa các phân tử. từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Walls, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
3. Tính chất hóa học
- Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng.
Sơ đồ tổng quát: X + 1e X–
- Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
a. Tác dụng với kim loại
Các halogen phản ứng trực tiếp với nhiều kim loại, tạo muối halide thể hiện ở các mức độ khác nhau:
- Fluorine tác dụng được với tất cả kim loại. Ví dụ:
2Ag + F2 2AgF
- Chlorine tác dụng hầu hết kim loại (từ Au và Pt). Ví dụ:
2Fe + Cl2 2FeCl3
- Bromine phản ứng với nhiều kim loại, nhưng khả năng phản ứng yếu hơn so với fluorine và chlorine. Ví dụ:
2Na + Br2 2NaBr
- Iodine phản ứng với kim loại yếu hơn so với bromine, chlorine và fluorine. Ví dụ trong phản ứng với aluminium, bromine phản ứng mạnh ở điều kiện thường, iodine cần nước làm chất xúc tác để phản ứng xảy ra:
2Al + 3I2 2AlI3
b. Tác dụng với hydrogen
Các halogen phản ứng với hydrogen, tạo thành hydrogen halide.
|
Phản ứng tạo H–X |
Điều kiện và mức độ phản ứng |
Đặc điểm phản ứng |
Năng lượng liên kết H–X (kJ/mol) |
|
H2 + F2 2HF |
Phản ứng ngay ở nhiệt độ phòng và trong bóng tối |
Nổ mạnh |
565 |
|
H2 + Cl2 2HCl |
Ánh sáng hoặc t0 |
Gây nổ |
431 |
|
H2 + Br2 2HBr |
≈ 200 ℃, xúc tác Pt |
Không gây nổ |
364 |
|
|
≈ 300 ℃, xúc tác Pt |
Thuận nghịch |
297 |
- Mức độ phản ứng của các halogen với hydrogen giảm dần khi đi từ fluorine đến iodine, phù hợp với tính oxi hóa của các halogen giảm dần từ F2 đến I2.
- Các phản ứng đều tạo phân tử HX. Giá trị năng lượng liên kết H–X giảm dần làm cho độ bền nhiệt của các phân tử giảm dần từ HF đến HI. Trong đó, phân tử HI có độ bền nhiệt thấp, dễ bị phân hủy một phần để tái tạo lại iodine và hydrogen.
c. Tác dụng với nước
- Fluorine phản ứng mạnh với nước, bốc cháy trong hơi nước nóng:
2F2 + 2H2O 4HF + O2
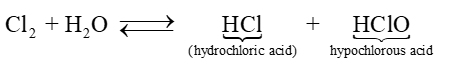
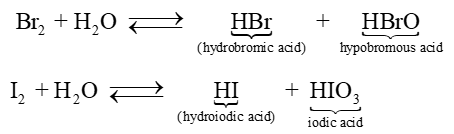
- Chlorine và bromine tác dụng chậm với nước, tạo thành hydrohalic acid và hypohalous acid, khả năng phản ứng với nước của bromine khó khăn hơn. Iodine phản ứng rất chậm với nước tạo iodic acid:
Hypochlorous acid có tính oxi hóa mạnh nên chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
d. Tác dụng với dung dịch kiềm
- Chlorine phản ứng với dung dịch kiềm ở điều kiện thường, tạo thành nước Javel.
Cl2 + 2NaOH NaCl + NaClO + H2O
Nước Javel (chứa NaClO, NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
- Khi đun nóng, Cl2 phản ứng với dung dịch kiềm tạo thành muối chlorate:
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
Potassium chlorate là chất oxi hóa mạnh, được sử dụng chế tạo thuốc nổ, hỗn hợp đầu que diêm,…
3. Tác dụng với dung dịch muối halide
|
Ống nghiệm |
1 |
2 |
|
Bước 1: Lấy vào mỗi ống nghiệm khoảng |
2 mL dung dịch NaBr |
2 mL dung dịch NaI |
|
Bước 2: Cho vào mỗi ống nghiệm khoảng |
1 mL nước chlorine |
1 mL nước bromine, vài giọt hồ tinh bột |
|
Bước 3: Lắc đều, để ổn định |
||
|
Hiện tượng |
Dung dịch có màu vàng |
Dung dịch có màu đen tím |
(1) Cl2 + 2NaBr 2NaCl + Br2
Chlorine oxi hóa ion bromide thành bromine, dung dịch bromine có màu vàng.
(2) Br2 + 2NaI 2NaBr + I2
Bromine oxi hóa ion iodide thành iodine, I2 tan tốt trong dung dịch NaI, dung dịch sẫm màu. Iodine kết hợp với hồ tinh bột sẽ tạo thành dung dịch màu đen tím.
4. Điều chế Cl2
a. Phòng thí nghiệm
- Cho dung dịch HCl đặc tác dụng với các chất oxi hóa mạnh: MnO2, KMnO4, K2Cr2O7,…
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O
b. Trong công nghiệp
2NaCl + 2H2O 2NaOH + Cl2 + H2
II. ĐỀ TỰ LUYỆN PHẦN LÍ THUYẾT
2.1. Phần tự luận
Câu 1: Nối mỗi trong cột A với những tính chất tương ứng của chúng trong cột B
|
Cột A |
Cột B |
|
a) Chlorine, Cl2 |
1. Hầu như không tan trong nước. |
|
b) Iodine, I2 |
2. Là chất khí ở điều kiện thường. |
|
3. Là chất rắn ở điều kiện thường. |
|
|
4. Là chất oxi hóa khi phản ứng với kim loại. |
|
|
5. Có tính độc cao. |
|
|
6. Có tương tác van der Walls mạnh nhất trong nhóm đơn chất halogen. |
|
|
7. Dùng để xử lí nước sinh hoạt. |
Câu 2: Xác nhận đúng, sai cho các phát biểu trong bảng sau:
|
STT |
Phát biểu |
Xác nhận |
|
|
Đúng |
Sai |
||
|
1 |
Halogen vừa có tính khử, vừa có tính oxi hóa. |
||
|
2 |
Nước chlorine và Javel đều có tính tẩy màu. |
||
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên. |
||
|
4 |
Cl2 có tính oxi hóa mạnh hơn Br2. |
||
|
5 |
Cl2 khử được I– trong dung dịch NaI thành I2. |
||
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen. |
||
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon. |
||
Câu 3: Hoàn thành phương trình hóa học của các phản ứng chứng minh tính chất halogen:
a) Br2 + K
b) F2 + H2O
c) Cl2 + Ca(OH)2
d) Cl2 + NaI
Nhận xét vai trò của halogen trong các phản ứng trên.
Câu 4: Hoàn thành các phương trình minh họa tính chất hóa học của các nguyên tố halogen:
a) Cl2 + H2
b) F2 + Cu
c) Cl2 + Fe
d) I2 + Na
e) Br2 + Ca(OH)2
f) Cl2 + KOH
g) Br2 + KI
Câu 5:
a) Xác định số oxi hóa của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4.
b) Từ số oxi hóa của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?
Câu 6: Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride, sodium chlorate và nước. Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử?
Câu 7: Nhúng giấy quỳ vào dung dịch nước chlorine thì giấy quỳ chuyển sang màu đỏ. Nhưng ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất. Hãy giải thích hiện tượng này?
Câu 8: Ở các đô thị, khi thay nước cho các bồn nuôi cá cảnh, người ta không cho trực tiếp nước sinh hoạt (nước máy) vào bồn cá. Nước này phải được chứa trong xô, thau, chậu khoảng một ngày rồi mới được cho vào bồn nuôi cá. Hãy giải thích?
Câu 9: Giá trị độ âm điện của halogen và hydrogen trong bảng sau:
|
Nguyên tố |
H |
F |
Cl |
Br |
I |
|
Độ âm điện |
2,20 |
3,98 |
3,16 |
2,96 |
2,66 |
Dựa vào giá trị độ âm điện, sắp xếp theo thứ tự giảm dần khả năng liên kết của halogen với hydrogen. So sánh độ phân cực của các phân tử hydrogen halide.
Câu 10: Cho phương trình hóa học của 2 phản ứng như sau:
Cl2 + 2NaBr 2NaCl + Br2(1)
Br2 + 2NaI 2NaBr + I2(2)
Phương trình chứng minh tính chất nào của halogen?
Câu 11: Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu.
Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh để quan sát khả năng hòa tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp.
Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên có màu da cam.
Viết phương trình hóa học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hóa học nào của halogen tương ứng?
Câu 12: Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối X của potassium (K). Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng. Nhỏ vài giọt nước Br2 vào ống thứ hai, lắc đều rồi thêm hồ tinh bột, thấy có màu xanh tím. Xác định công thức hóa học của X và viết PTHH của các phản ứng.
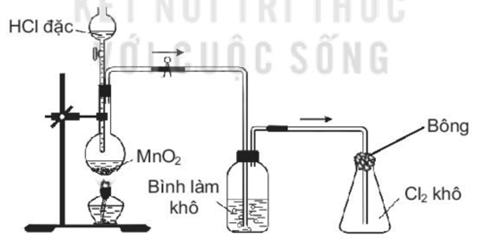
Câu 13: Trong phòng thí nghiệm, khí chlorine được điều chế, làm khô và thu vào bình theo sơ đồ dưới đây:
Hãy đề xuất một dung dịch để sử dụng cho từng mục đích sau:
a) Cho vào bình làm khô để làm khô khí Cl2.
b) Tẩm vào bông đậy bình thu khí để hạn chế khí Cl2 bay ra.
Giải thích và viết PTHH minh họa nếu có.
Câu 14: Trong công nghiệp, sodium chloride được đem điện phân để có phản ứng theo phương trình hóa học sau: NaCl(aq) + H2O(l) A(aq) + X(g) + Y(g)
Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến. Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
a) Hãy cho biết công thức hóa học của A, X, Y.
b) Hoàn thành PTHH của các phản ứng xảy ra.
Câu 15: Một trong những ứng dụng của chlorine trong đời sống là khử trùng nước sinh hoạt tại các nhà máy xử lí và cấp nước. Trong quá trình khử trùng, người ta phải cho một lượng chlorine dư vào nước sinh hoạt. Lượng chlorine dư trong nước sinh hoạt còn có tác dụng ngăn ngừa sự tái nhiễm của vi khuẩn trong quá trình phân phối trong đường ống dẫn nước và trữ nước tại nhà.
Theo quy chuẩn kĩ thuật quốc gia (QCVN 01 – 1: 2018/BYT), hàm lượng chlorine tự do đối với nước sạch sử dụng cho mục đích sinh hoạt từ 0,2 – 1 mg/L. Nếu hàm lượng chlorine nhỏ hơn 0,2 – 1 mg/L thì không tiêu diệt hết vi khuẩn và không xử lí được hết chất hữu cơ. Ngược lại, lượng chlorine trong nước lớn hơn 1,0 mg/L sẽ gây dị ứng.
Carbon trong than hoạt tính sẽ tương tác trực tiếp với chlorine, giúp loại bỏ chlorine và các hợp chất chlorine bằng cơ chế hấp thụ bề mặt. Khi chiếu tia cực tím với cường độ cao vào nước cũng làm giảm lượng chlorine. Các máy lọc nước RO (reverse osmosis: thẩm thấu ngược) cũng có thể giúp loại bỏ lượng chlorine trong nước một cách hiệu quả.
Hãy trả lời các câu hỏi sau đây:
a) Dấu hiệu nào cho thấy chlorine có trong nước sinh hoạt?
b) Vì sao người ta cần cho chlorine đến dư vào nước sinh hoạt?
c) Cho biết một số phương pháp có thể loại bỏ khí chlorine dư trong nước sinh hoạt.
2.2. Đáp án phần tự luận
Câu 1: Nối mỗi chất trong cột A với những tính chất tương ứng của chúng trong cột B
|
Cột A |
Cột B |
|
a) Chlorine, Cl2 |
1. Hầu như không tan trong nước. |
|
b) Iodine, I2 |
2. Là chất khí ở điều kiện thường. |
|
3. Là chất rắn ở điều kiện thường. |
|
|
4. Là chất oxi hóa khi phản ứng với kim loại. |
|
|
5. Có tính độc cao. |
|
|
6. Có tương tác van der Walls mạnh nhất trong nhóm đơn chất halogen. |
|
|
7. Dùng để xử lí nước sinh hoạt. |
Giải:
a – 2, 4, 5, 7; b – 1, 3, 4, 6.
Câu 2: Xác nhận đúng, sai cho các phát biểu trong bảng sau:
|
STT |
Phát biểu |
Xác nhận |
|
|
Đúng |
Sai |
||
|
1 |
Halogen vừa có tính khử, vừa có tính oxi hóa. |
||
|
2 |
Nước chlorine và Javel đều có tính tẩy màu. |
||
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên. |
||
|
4 |
Cl2 có tính oxi hóa mạnh hơn Br2. |
||
|
5 |
Cl2 khử được I– trong dung dịch NaI thành I2. |
||
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen. |
||
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon. |
||
Giải:
|
STT |
Phát biểu |
Xác nhận |
|
|
Đúng |
Sai |
||
|
1 |
Halogen vừa có tính khử, vừa có tính oxi hóa. |
x |
|
|
2 |
Nước chlorine và Javel đều có tính tẩy màu. |
x |
|
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên. |
x |
|
|
4 |
Cl2 có tính oxi hóa mạnh hơn Br2. |
x |
|
|
5 |
Cl2 khử được I– trong dung dịch NaI thành I2. |
x |
|
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen. |
x |
|
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon. |
x |
|
Câu 3: Hoàn thành phương trình hóa học của các phản ứng chứng minh tính chất halogen:
a) Br2 + K
b) F2 + H2O
c) Cl2 + Ca(OH)2
d) Cl2 + NaI
Nhận xét vai trò của halogen trong các phản ứng trên.
Giải:
a) Br2 + 2K 2KBr
(Br2 là chất oxi hóa)
b) 2F2 + 2H2O O2 + 4HF
(F2 là chất oxi hóa)
c) Cl2 + Ca(OH)2 CaOCl2 + H2O
(Cl2 vừa là chất oxi hóa, vừa là chất khử)
p>d) Cl2 + 2NaI 2NaCl + I2
(Cl2 là chất oxi hóa)
Câu 4: Hoàn thành các phương trình minh họa tính chất hóa học của các nguyên tố halogen:
a) Cl2 + H2
b) F2 + Cu
c) Cl2 + Fe
d) I2 + Na
e) Br2 + Ca(OH)2
f) Cl2 + KOH
g) Br2 + KI
Giải:
a) Cl2 + H2 2HCl
b) F2 + Cu CuF2
c) 3Cl2 + 2Fe 2FeCl3
d) I2 + 2Na 2NaI
e) 2Br2 + 2Ca(OH)2 CaBr2 + Ca(BrO)2 + 2H2O
f) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
g) Br2 + 2KI 2KBr + I2
Câu 5: a) Xác định số oxi hóa của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4.
b) Từ số oxi hóa của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?
Giải:
a)
b) Cl2 vừa có tính oxi hóa vừa có tính khử do có số oxi hóa trung gian.
Câu 6: Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride, sodium chlorate và nước. Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử?
Giải:
Câu 7: Nhúng giấy quỳ vào dung dịch nước chlorine thì giấy quỳ chuyển sang màu đỏ. Nhưng ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất. Hãy giải thích hiện tượng này?
Giải:
- Trong dung dịch chứa HCl nên giấy quỳ tím chuyển sang đỏ.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 10 hay, chi tiết khác:
Chuyên đề Bảng tuần hoàn các nguyên tố hóa học
Chuyên đề Phản ứng oxi hóa - khử
Chuyên đề Tốc độ phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức