Chuyên đề Hóa 12 Bài 7 (Cánh diều): Liên kết và cấu tạo của phức chất
Với giải bài tập Chuyên đề Hóa 12 Bài 7: Liên kết và cấu tạo của phức chất sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 12 Bài 7.
Giải Chuyên đề Hóa 12 Bài 7: Liên kết và cấu tạo của phức chất
Mở đầu trang 43 Chuyên đề Hóa học 12: Bằng thực nghiệm, người ta xác định được cấu tạo của phức chất [NiCl4]2- như hình bên. Hãy cho biết:
a) Dạng hình học của phức chất.
b) Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như thế nào?
Lời giải:
a) Dạng hình học của phức chất là: dạng tứ diện.
b) Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như sau:
Phức chất có điện tích là -2, mỗi ion Cl− có điện tích là -1 nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Ni2+ là: [Ar]3d84s04p0.
Cấu hình electron hoá trị dạng ô orbital của Ni2+ là:
Cation Ni2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi anion Cl- cho mỗi orbital lai hoá trống của cation Ni2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
I. Liên kết và cấu tạo phức chất theo thuyết liên kết hoá trị
Câu hỏi trang 44 Chuyên đề Hóa học 12: Xác định điện tích của nguyên tử trung tâm trong phức chất [Cd(NH3)4]2+
Lời giải:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Luyện tập 1 trang 45 Chuyên đề Hóa học 12: Thực nghiệm xác nhận phức chất [Zn(NH3)4]2+ có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và mô tả cấu tạo phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [Zn(NH3)4]2+ như sau:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Zn2+ là: [Ar]3d104s04p0.
Cấu hình electron hoá trị dạng ô orbital của Zn2+ là:
Cation Zn2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi phân tử NH3 cho mỗi orbital lai hoá trống của cation Zn2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
Luyện tập 2 trang 45 Chuyên đề Hóa học 12: Thực nghiệm xác nhận phức chất [FeF6]4- có dạng hình học bát diện. Giải thích sự tạo thành liên kết và mô tả cấu tạo phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
Phức chất có điện tích là -4, mỗi ion F− có điện tích là -1 nên điện tích của cation nguyên tử trung tâm là +2.
Cấu hình electron của Fe2+: [Ar]3d64s04p0.
Cấu hình electron hoá trị dạng ô orbital của Fe2+ là:
Cation Fe2+ sử dụng 1 orbital 4s trống, 3 orbital 4p trống và 2 orbital 4d trống để lai hoá sp3d2, tạo nên 6 orbital lai hoá trống.
Mỗi ion F− cho mỗi orbital lai hoá trống của cation Fe2+ một cặp electron chưa liên kết để hình thành 1 liên kết cho – nhận.
II. Dạng hình học của phức chất
Luyện tập 3 trang 46 Chuyên đề Hóa học 12: Theo thực nghiệm, phức chất [Fe(CN)6]3- có dạng hình học bát diện. Hãy vẽ dạng hình học của phức chất này.
Lời giải:
Dạng hình học của phức chất [Fe(CN)6]3- :
Luyện tập 4 trang 46 Chuyên đề Hóa học 12: Theo thực nghiệm, phức chất [Cd(NH3)4]2+ có dạng hình học tứ diện. Hãy vẽ dạng hình học của phức chất này.
Lời giải:
Dạng hình học của phức chất: [Cd(NH3)4]2+
III. Đồng phân phức chất
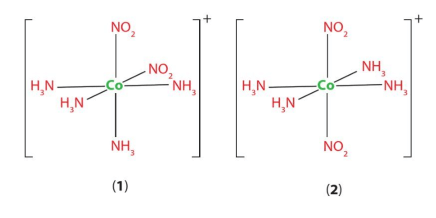
Luyện tập 5 trang 46 Chuyên đề Hóa học 12: Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4]+ ở Hình 7.3.
Lời giải:
Ta có:
+ Ở đồng phân cis, hai phối tử giống nhau ở cùng một phía so với nguyên tử trung tâm.
+ Ở đồng phân trans, hai phối tử giống nhau ở hai phía so với nguyên tử trung tâm.
Vậy: (I) là đồng phân trans; (II) là đồng phân cis.
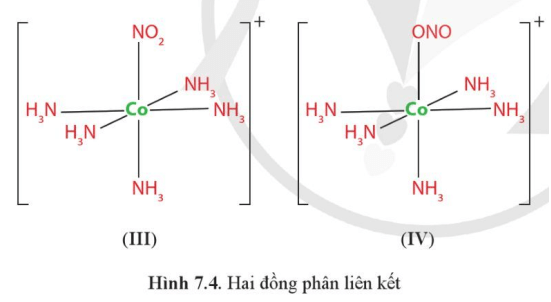
Luyện tập 6 trang 47 Chuyên đề Hóa học 12: Vì sao nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV)?
Lời giải:
Nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV) vì nguyên tử N hay O trong anion NO2− đều có thể cho vào orbital trống của nguyên tử Co2+ cặp electron liên kết.
Luyện tập 7 trang 48 Chuyên đề Hóa học 12: Hãy cho biết hai phức chất dưới đây có phải là đồng phân của nhau không. Giải thích.
[PtCl2(NH3)4]Br2 và [PtBr2(NH3)4]Cl2
Lời giải:
Hai phức chất [PtCl2(NH3)4]Br2 và [PtBr2(NH3)4]Cl2 là đồng phân ion hoá do chúng có cùng thành phần nhưng có sự hoán đổi vị trí của anion ở ngoài dấu móc vuông và trong dấu móc vuông.
Bài tập (trang 48)
Bài tập 1 trang 48 Chuyên đề Hóa học 12: Phức chất [CoCl4]2- có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
- Giải thích sự tạo thành liên kết trong phức chất [CoCl4]2-:
Phức chất có điện tích là -2, mỗi ion Cl− có điện tích là -1 nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Co2+ là: [Ar]3d74s04p0.
Cấu hình electron hoá trị dạng ô orbital của Co2+ là:
Cation Co2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi anion Cl- cho mỗi orbital lai hoá trống của cation Co2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
- Dạng hình học của phức chất [CoCl4]2- theo thuyết Liên kết hóa trị:
Bài tập 2 trang 48 Chuyên đề Hóa học 12: Phức chất [Co(OH2)6]2+ có dạng hình học bát diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
- Giải thích sự tạo thành liên kết trong phức chất [Co(OH)6]2+:
Phức chất có điện tích là +2, mỗi phân tử H2O có điện tích là 0 (trung hoà về điện) nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Co2+ là: [Ar]3d74s04p0.
Cấu hình electron hoá trị dạng ô orbital của Co2+ là:
Cation Co2+ sử dụng 1 orbital 4s trống, 3 orbital 4p trống và 2 orbital 4d trống để lai hoá sp3d2, tạo nên 6 orbital lai hoá trống.
Mỗi phân tử H2O cho mỗi orbital lai hoá trống của cation Co2+ một cặp electron chưa liên kết để hình thành 1 liên kết cho – nhận.
- Dạng hình học của phức chất [Co(OH)6]2+:
Bài tập 3 trang 48 Chuyên đề Hóa học 12: Chỉ ra dạng cis và dạng trans trong hai đồng phân dưới đây:
Lời giải:
Ta có:
+ Ở đồng phân cis, hai phối tử giống nhau ở cùng một phía so với nguyên tử trung tâm.
+ Ở đồng phân trans, hai phối tử giống nhau ở hai phía so với nguyên tử trung tâm.
Vậy: (1) là đồng phân cis; (2) là đồng phân trans;
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều

![Bằng thực nghiệm người ta xác định được cấu tạo của phức chất [NiCl4]2 như hình bên](https://vietjack.com/chuyen-de-hoa-12/images/mo-dau-trang-43-chuyen-de-hoa-hoc-12-cd.PNG)
![Bằng thực nghiệm người ta xác định được cấu tạo của phức chất [NiCl4]2 như hình bên](https://vietjack.com/chuyen-de-hoa-12/images/mo-dau-trang-43-chuyen-de-hoa-hoc-12-cd-2.PNG)
![Thực nghiệm xác nhận phức chất [Zn(NH3)4]2 có dạng hình học tứ diện. Giải thích](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-1-trang-45-chuyen-de-hoa-hoc-12-cd.PNG)
![Thực nghiệm xác nhận phức chất [FeF6]4 có dạng hình học bát diện. Giải thích](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-2-trang-45-chuyen-de-hoa-hoc-12-cd.PNG)
![Theo thực nghiệm phức chất [Fe(CN)6]3 có dạng hình học bát diện. Hãy vẽ dạng hình học](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-3-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Theo thực nghiệm phức chất [Cd(NH3)4]2 có dạng hình học tứ diện. Hãy vẽ dạng hình học](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-4-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4] ở Hình 7.3](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-5-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [CoCl4]2 có dạng hình học tứ diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-1-trang-48-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [CoCl4]2 có dạng hình học tứ diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-1-trang-48-chuyen-de-hoa-hoc-12-cd-2.PNG)
![Phức chất [Co(OH2)6]2 có dạng hình học bát diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-2-trang-48-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [Co(OH2)6]2 có dạng hình học bát diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-2-trang-48-chuyen-de-hoa-hoc-12-cd-2.PNG)