Câu hỏi:
11/11/2024 332
Phát biểu nào sau đây là sai?
A. Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần.
B. Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng,
C. Kim loại có độ âm điện bé hơn phi kim trong cùng chu kì.
D. Đa số các kim loại đều có cấu tạo tinh thể.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là : A
- Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần là sai
- Trong một chu kỳ, khi điện tích hạt nhân tăng thì tính kim loại không tăng dần mà ngược lại, tính kim loại giảm dần. Điều này là do các yếu tố sau:
+ Sự tăng của điện tích hạt nhân: Khi đi từ trái sang phải trong cùng một chu kỳ, điện tích hạt nhân tăng lên, kéo các electron về gần hạt nhân hơn. Điều này làm cho nguyên tử khó mất electron hơn, dẫn đến tính kim loại giảm.
+ Độ âm điện và năng lượng ion hóa tăng: Độ âm điện (khả năng hút electron) và năng lượng ion hóa (năng lượng cần để tách electron ra khỏi nguyên tử) đều tăng dần khi đi từ trái sang phải. Các nguyên tố càng về bên phải của chu kỳ càng dễ thu nhận electron để đạt cấu hình bền vững, vì vậy tính phi kim tăng lên.
+ Sự thay đổi cấu hình electron: Các nguyên tố ở bên trái chu kỳ thường có cấu hình electron dễ mất electron để trở thành ion dương (tính kim loại cao), trong khi các nguyên tố bên phải lại dễ thu electron để đạt cấu hình bền hơn (tính phi kim cao hơn).
- Vì vậy, khi điện tích hạt nhân tăng trong cùng một chu kỳ, tính kim loại không tăng mà ngược lại, nó giảm dần.
→ A đúng.B,C,D sai.
* Cấu tạo của kim loại
1. Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
Ví dụ:
+ Na: [Ne]3s1 có 1electron ở lớp ngoài cùng.
+ Mg: [Ne]3s2 có 2 electron ở lớp ngoài cùng.
+ Al: [Ne]3s23p1 có 3 electron ở lớp ngoài cùng.
- Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim.
Ví dụ xét với chu kì 3:
|
Nguyên tử |
11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
|
rnt |
0,157 |
0,136 |
0,125 |
0,117 |
0,110 |
0,104 |
0,099 |
2. Cấu tạo tinh thể
- Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, còn các kim loại khác ở thể rắn, có cấu tạo tinh thể.
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách ra khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
- Có ba kiểu mạng tinh thể kim loại đặc trưng là: lập phương tâm khối, lập phương tâm diện và lục phương.
a) Mạng tinh thể lục phương
- Đặc điểm: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
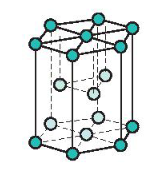
Mạng tinh thể lục phương
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Be, Mg, Zn …
b) Mạng tinh thể lập phương tâm diện
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
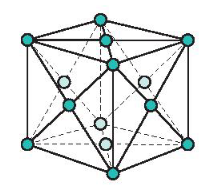
Mạng tinh thể lập phương tâm diện
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Cu, Ag, Au, Al …
c) Mạng tinh thể lập phương tâm khối
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm của hình lập phương.
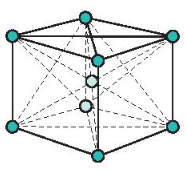
Mạng tinh thể lập phương tâm khối
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chỉ chiếm 68%, còn lại 32% là các không gian trống.
- Thuộc loại này có các kim loại: Li, Na, K, V, Mo …
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hoá 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Mục lục Giải SBT Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Nhóm nào trong bảng tuần hoàn hiện nay chứa toàn bộ là các nguyên tố kim loại?
Câu 3:
Khi hoà tan hoàn toàn 3 gam hỗn hợp hai kim loại nhóm IA trong dung dịch HCl dư thu được 0,672 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được a gam muối khan, giá trị của a là
Câu 5:
R là một kim loại thuộc nhóm IA của bảng tuần hoàn. Lấy 17,55 gam R tác dụng với 25 gam dung dịch HCl 29,2%. Sau phản ứng xảy ra hoàn toàn cho bốc hơi cẩn thận dung dịch tạo thành trong điều kiện không có không khí thì thu được 28,9 gam hỗn hợp rắn gồm hai chất. Kim loại R là
Câu 6:
Cho 2,4 g kim loại M hóa trị II tan hết vào dung dịch HCl dư thu được 2,24 lít khí H2 ở đktc. Kim loại M là
Câu 7:
Ion M2+ có cấu hình electron ở lớp ngoài cùng là 3s2 3p6 3d6 .Vị trí của M trong bảng tuần hoàn là:
Câu 8:
Kim loại M phản ứng với oxi để tạo thành oxit. Khối lượng oxi đã phản ứng bằng 40% khối lượng kim loại đã dùng. Kim loại M là:
Câu 9:
Nguyên tố X ở ô số 24 của bảng tuần hoàn. Một học sinh đã đưa ra các nhận xét về nguyên tố X như sau :
(1) X có 6 e hoá trị và là nguyên tố kim loại.
(2) X là một nguyên tố nhóm d.
(3) X nằm ở chu kì 4 của bảng tuần hoàn.
(4) Ở trạng thái cơ bản, X có 6 e ở phân lớp s;
Trong các nhận xét trên, số nhận xét đúng là
Nguyên tố X ở ô số 24 của bảng tuần hoàn. Một học sinh đã đưa ra các nhận xét về nguyên tố X như sau :
(1) X có 6 e hoá trị và là nguyên tố kim loại.
(2) X là một nguyên tố nhóm d.
(3) X nằm ở chu kì 4 của bảng tuần hoàn.
(4) Ở trạng thái cơ bản, X có 6 e ở phân lớp s;
Trong các nhận xét trên, số nhận xét đúng là


