Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ (có đáp án)
Trắc nghiệm Bài 42: Luyện tập nhận biết một số hợp chất vô cơ
-
464 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trích mẫu thử của ba dung dịch ra ba ống nghiệm có đánh số.
Cho một ít bột Cu vào ba mẫu thử.
+ Dung dịch không hòa tan được Cu là HCl.
+ Dung dịch hòa tan Cu và giải phóng khí mùi hắc là H2SO4 đặc nguội.
![]()
+ Dung dịch hòa tan Cu và giải phóng khí màu đỏ nâu là HNO3 đặc nguội.
![]()
Câu 2:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. Dùng H2O, dung dịch H2SO4
+ Dùng nước để hòa tan các chất rắn tạo thành dung dịch.
+ Sử dụng dung dịch H2SO4 làm thuốc thử để nhận biết các dung dịch thì chỉ nhận biết được dung dịch CaCl2 do xuất hiện kết tủa trắng không tan trong axit dư: CaCl2 + H2SO4 CaSO4 + 2HCl
B. Dùng H2O, dung dịch NaOH, dung dịch Na2CO3
+ Dùng H2O để hòa tan các chất rắn tạo dung dịch.
+ Dùng dung dịch NaOH nhận biết được MgCl2 do có hiện tượng xuất hiện kết tủa trắng:
MgCl2 + 2NaOH Mg(OH)2+ 2NaCl
+ Dùng dung dịch Na2CO3 nhận biết được CaCl2 do có hiện tượng xuất hiện kết tủa trắng:
CaCl2 + Na2CO3 CaCO3+ 2NaCl
Do đó chất còn lại là NaCl.
C. Dùng H2O, dung dịch Na2CO3
+ Dùng nước hòa tan các chất rắn tạo thành dung dịch
+ Dùng dung dịch Na2CO3 làm thuốc thử nhận biết các dung dịch, ta chỉ nhận biết được dung dịch HCl vì khi đổ lần lượt dung dịch Na2CO3 vào các mẫu thử thì dung dịch NaCl không có hiện tượng gì còn 2 dung dịch MgCl2 và CaCl2 phản ứng tạo kết tủa trắng:
MgCl2 + Na2CO3 MgCO3 + 2NaCl
CaCl2 + Na2CO3 CaCO3 + 2NaCl
D. Dung dịch HCl, dung dịch Na2CO3
Chỉ sử dụng được dung dịch Na2CO3 để nhận biết được dung dịch NaCl: Khi hòa tan các chất rắn vào dung dịch Na2CO3 thì:
+ NaCl tan.
+ CaCl2 và MgCl2 tan và phản ứng tạo kết tủa màu trắng:
CaCl2 + Na2CO3 CaCO3 + 2NaCl
MgCl2 + Na2CO3 MgCO3 + 2NaCl
Câu 3:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D

Phương trình phản ứng:
Al2O3 + 2NaOH dư → 2NaAlO2 + H2O
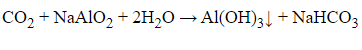
2Al(OH)3 Al2O3 + 3H2O
Trong những bài tách chất như thế này, các hóa chất dùng cho quá trình tách đều cần dùng dư vì chúng ta không biết tạp chất chiếm bao nhiêu hay lượng cụ thể như thế nào.
Câu 4:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng:
![]()
A. Khi ban đầu cho qua dung dịch Na2CO3 thì CO2 có thể phản ứng theo phương trình:
Na2CO3 + CO2 + H2O 2NaHCO3
→ Do đó không sử dụng được Na2CO3.
B. Ban đầu cho qua dung dịch NaHCO3 → hấp thụ được HCl, sau đó cho qua CaO khan thì CO2 có thể bị hấp thụ:
CaO + CO2 CaCO3
→ Do đó không sử dụng được CaO.
C. Dùng P2O5 hấp thụ được H2O và dùng dung dịch NaCl hấp thụ được HCl nhưng sau khi cho hỗn hợp khí qua dung dịch NaCl thì có thể lẫn thêm nước từ dung dịch. Do đó cách làm này chưa hoàn toàn hợp lí.
D. Cho hỗn hợp khí và hơi qua bình đựng dung dịch NaHCO3 dư, hiđroclorua bị giữ lại.
![]()
Tiếp tục cho hỗn hợp còn lại đi qua bình đựng H2SO4 đặc, hơi nước bị hấp thụ. Ta thu được CO2 tinh khiết.
Câu 5:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Nhận biết ion Ba2+ bằng dung dịch Na2CrO4 cho kết tủa màu vàng tươi.
![]()
Câu 6:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trích mẫu thử của 4 dung dịch ra 4 ống nghiệm có đánh số
Nhỏ dung dịch AgNO3 vào từng mẫu thử để nhận biết
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa trắng là HCl:
AgNO3 + HCl AgCl + HNO3
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa vàng đậm là KI:
AgNO3 + KI AgI + KNO3
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa vàng nhạt là ZnBr2:
2AgNO3 + ZnBr2 Zn(NO3)2 + 2AgBr
+ Dung dịch khi cho AgNO3 không có hiện tượng gì là Mg(NO3)2
Câu 7:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
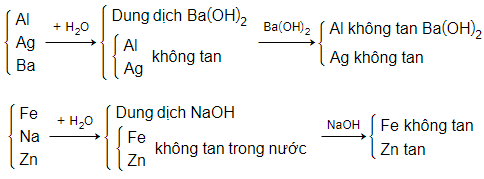
C. Cả Mg, Ag và Cu đều không tan trong nước → Không nhận biết được.
Câu 8:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Chỉ có MgO và Al2O3 tan trong dung dịch HCl
Chú ý: Trong 3 chất trên, chỉ có SiO2 tan được trong dung dịch NaOH đun nóng, tuy nhiên nếu chọn đáp án A, ta chưa có bước tái tạo lại SiO2 ban đầu. Để tái tạo lại SiO2 ta có thể thực hiện các quá trình theo các phương trình phản ứng sau:
SiO2 + 2NaOH Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O H2SiO3 + Na2CO3
H2SiO3 SiO2 + H2O
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trích mẫu thử của mỗi dung dịch ra các ống nghiệm có đánh số.
Cho dung dịch AgNO3 vào các mẫu thử:
- Xuất hiện kết tủa trắng: KCl
KCl + AgNO3 → KNO3 + AgCl (↓ trắng)
- Xuất hiện kết tủa vàng: K3PO4
K3PO4 + 3AgNO3 → Ag3PO4 (↓ vàng) + 3KNO3
- Xuất hiện kết tủa đen: K2S
K2S + 2AgNO3 → Ag2S (↓ đen) + 2KNO3
- Không có hiện tượng gì: KNO3
Câu 10:
21/07/2024 Xem đáp án
Xem đáp án
A. FeCl2 + 2NaOH 2NaCl + Fe(OH)2¯ trắng xanh.
FeCl3 + 3NaOH 3NaCl + Fe(OH)3¯ đỏ nâu.
B. Mặc dù ion Fe2+ phản ứng được vói dung dịch KMnO4 / H+ nên làm mất màu dung dịch KMnO4 còn Fe3+ thì không nhưng cả hai muối cần nhận biết ở đây đều là muối clorua có gốc Cl- cũng có khả năng làm mất màu dung dịch KMnO4 trong môi trường axit đặc nên đều quan sát được hiện tượng: màu tím của dung dịch KMnO4 nhạt dần.
![]()
C. Hiện tượng quan sát được với cả hai mẫu thử: Xuất hiện kết tủa trắng (AgCl).
D. Cả hai mẫu thử đều không có hiện tượng gì.
Câu 11:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Cả 3 mẫu thử đều có hiện tượng chung là làm mất màu dung dịch KMnO4/H+ do cả 3 mẫu thử đều có chứa Fe2+:
![]()
Ngoài ra, ta còn quan sát được các hiện tượng khác nhận biết như sau:
+ Mẫu thử phản ứng giải phóng khí màu vàng lục, mùi xốc là FeCl2:
![]()
+ Mẫu thử phản ứng giải phóng khí không màu, sau đó hóa nâu trong không khí là Fe(NO3)2:
2NO + O2 2NO2 (nâu đỏ)
+ Mẫu thử phản ứng không xuất hiện khí là FeSO4
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Trích mẫu thử của ba chất rắn ra ba ống nghiệm có đánh số
Nhỏ dung dịch NaOH lần lượt vào từng mẫu thử.
Hiện tượng khi cho các mẫu thử vào dung dịch NaOH:
+ Tan và tạo khí không màu → Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
+ Tan và không có khí → Al2O3
Al2O3 + 2NaOH → 2NaAlO2 + H2O
+ Không tan → Mg
Câu 13:
19/07/2024Có các chất rắn: CaO, Ca, Al2O3 và Na. Chất nào có thể sử dụng để phân biệt các chất rắn đó.
 Xem đáp án
Xem đáp án
Đáp án A
Trích mẫu thử của 4 chất rắn ra 4 ống nghiệm có đánh số.
Hòa tan 4 mẫu thử bằng nước
Hiện tượng quan sát được khi hòa tan các mẫu thử vào nước:
+ Tan tạo dung dịch đục → CaO.
CaO + H2O Ca(OH)2
+ Tan tạo dung dịch đục đồng thời giải phóng khí không màu → Ca
Ca + 2H2O Ca(OH)2 + H2
+ Không tan → Al2O3
+ Tan tạo dung dịch trong, giải phóng khí không màu → Na
2Na + 2H2O 2NaOH + H2
Nguyên nhân khi sản phẩm tạo thành là dung dịch Ca(OH)2 thì hiện tượng quan sát được là dung dịch vẩn đục là Ca(OH)2 chỉ tan một phần trong nước tạo dung dịch và chính phần không tan này làm cho dung dịch vẩn đục.
Câu 14:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Chỉ có lọ đựng FeO + Fe2O3 phản ứng với HCl hoặc H2SO4 loãng không giải phóng khí. Các lọ còn lại chứa Fe phản ứng với HCl hoặc H2SO4 loãng giải phóng khí:
Fe + 2H+ Fe2+ + H2↑.
Còn với dung dịch HNO3 đặc thì cả 3 mẫu thử đều tan và giải phóng khí đỏ nâu.
Câu 15:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Đầu tiên, dùng H+ nhận biết được Ag không tan còn các kim loại kia đều tan và giải phóng khí không màu.
2Al + 6H+ → 2Al3+ + 3H2↑
Mg + 2H+ → Mg2+ + H2↑
Fe + 2H+ → Fe2+ + H2↑
Dùng dung dịch NaOH nhận biết kim loại từ các dung dịch thu được khi phản ứng với H+:
+ Dung dịch xuất hiện kết tủa keo trắng, tan trong OH– dư là dung dịch chứa Al3+. Kim loại ban đầu là Al.
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Dung dịch xuất hiện kết trắng xanh là dung dịch chứa Fe2+. Kim loại ban đầu là Fe.
Fe2+ + 2OH- → Fe(OH)2
+ Dung dịch xuất hiện kết tủa trắng là dung dịch chứa Mg2+. Kim loại ban đầu là Mg.
Mg2+ + 2OH- → Mg(OH)2
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Trích các mẫu thử của 4 chất rắn ra 4 ống nghiệm có đánh số.
Hòa tan 4 mẫu thử này bằng H2O
+ Mẫu thử tan trong H2O là K2O
K2O + H2O → 2KOH
+ Mẫu thử không tan trong H2O là MgO, Al2O3
+ Mẫu thử tan tạo kết tủa keo trắng Al(OH)3 và giải phóng khí là Al4C3
A14C3 + 12H2O 4Al(OH)3 + 3CH4
Sau đó lấy dung dịch KOH thu được từ bước nhận biết trên cho vào hai mẫu thử không tan trong nước, mẫu thử tan trong dung dịch KOH là Al2O3, mẫu thử không tan là MgO.
Al2O3 + 2KOH → 2KAlO2 + H2O
Câu 17:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trong dung dịch có anion tạo thành muối tan với mọi cation, còn lại 3 anion là , và ta lựa chọn hóa chất nào đó để kết hợp với tối đa 3 anion này để tạo thành kết tủa đồng thời hạn chế tối đa đưa thêm anion lạ vào dung dịch. Do đó sử dụng Ba(NO3)2 ta loại bỏ được cả 3 anion (hình thành kết tủa) và không đưa thêm anion lạ vào dung dịch.
Ba2+ + → BaCO3
3Ba2+ + 2 → Ba3(PO4)2
Ba2+ + → BaSO4
Câu 18:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Các dung dịch dùng để nhận biết và hiện tượng quan sát được:
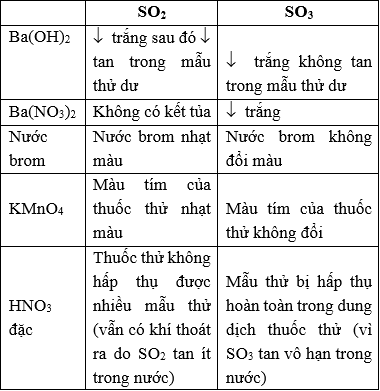
Câu 19:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
- Dung dịch Na2SO4, KCl có pH = 7, môi trường trung tính không làm quỳ tím đổi màu.
- Dung dịch HCl là dung dịch axit, pH < 7 làm quỳ tím hóa đỏ.
- Dung dịch kiềm NaOH có pH > 7, môi trường bazơ → làm quỳ tím hóa xanh
Câu 20:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
- Trích mẫu thử. Cho lần lượt các mẫu thử vào dung dịch H2SO4.
+ Mẫu thử sủi bọt khí không màu đồng thời xuất hiện ↓ trắng là Ba
Ba + H2SO4 → BaSO4 + H2
+ Mẫu thử chỉ sủi bọt khí không màu là Mg, Zn và Fe.
Mg + H2SO4 → MgSO4 + H2
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 → FeSO4 + H2
- Cho tiếp Ba dư vào rồi lọc bỏ kết tủa → thu được dung dịch chỉ chứa Ba(OH)2
- Lấy dung dịch này cho từ từ đến dư vào các dung dịch sản phẩm phía trên:
+ Dung dịch cho ↓ trắng → dung dịch là MgSO4 → mẫu thử là Mg.
![]()
+ Dung dịch cho ↓ xanh trắng → dung dịch là FeSO4 → mẫu thử là Fe.
Ba(OH)2 + FeSO4 → BaSO4+ Fe(OH)2
+ Dung dịch cho ↓ keo trắng lẫn kết tủa trắng rồi tan một phần → dung dịch là ZnSO4 → mẫu thử là Zn.
Ba(OH)2 + ZnSO4 → BaSO4 + Zn(OH)2
Zn(OH)2 + Ba(OH)2 → BaZnO2 + 2H2O
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Thuốc thử duy nhất dùng để nhận biết 4 dung dịch trên là dung dịch Ba(HCO3)2 . Ta có cách nhận biết như sau:
+ Khi cho lần lượt dung dịch Ba(HCO3)2 vào các mẫu thử thì:
Mẫu thử phản ứng giải phóng khí là dung dịch HCl:
Ba(HCO3)2 + 2HCl BaCl2 + 2CO2 + 2H2O
Mẫu thử phản ứng tạo kết tủa trắng là NaOH:
2NaOH + Ba(HCO3)2 Na2CO3 + BaCO3 + 2H2O
Mẫu thử phản ứng tạo kết tủa trắng đồng thời giải phóng khí là:
Ba(HCO3)2 + H2SO4 BaSO4 + 2CO2 + 2H2O
Mẫu thử không hiện tượng là dung dịch NaCl.
Câu 22:
17/07/2024Để phân biệt Al3+ và Zn2+ không dùng thuốc thử
 Xem đáp án
Xem đáp án
Đáp án B
Al3+ và Zn2+ đều tạo kết tủa keo và tan trong NaOH dư
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Zn2+ + 2OH- → Zn(OH)2
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Câu 23:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Dùng Ba(OH)2 thì:
+) NH4Cl: khí mùi khai
NH4+ + OH- → NH3 + H2O
+) AlCl3: Kết tủa keo sau đó tan
Al3+ + 3OH- → Al(OH)3
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+) FeCl3: Kết tủa nâu đỏ
Fe3+ + 3OH- → Fe(OH)3
+) Na2SO4: kết tủa trắng
Ba2+ + → BaSO4
+) (NH4)2SO4: kết tủa trắng + khí mùi khai
Ba2+ + → BaSO4
NH4+ + OH- → NH3 + H2O
+) NaCl: không có hiện tượng gì
Câu 24:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Dung dịch AgNO3 không phân biệt được 2 dung dịch vì đều tạo kết tủa trắng.
HCl + AgNO3 → AgCl + HNO3
Na2CO3 + 2AgNO3 → 2NaNO3 + Ag2CO3
Câu 25:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Sử dụng hóa chất: AgNO3
Hiện tượng: Xuất hiện kết tủa trắng
Phương trình hóa học minh họa:
KCl + AgNO3 → AgCl (↓ trắng) + KNO3
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
- Trích mẫu thử của mỗi chất cho ra các ống nghiệm khác nhau và đánh số thứ tự
- Nhỏ từ từ dung dịch HCl và từng mẫu thử.
+ Xuất hiện bọt khí: NaHCO3
NaHCO3 + HCl → NaCl + CO2+ H2O
+ Không có hiện tượng gì: Na2SO4
Câu 27:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. Sử dụng dung dịch BaCl2 làm thuốc thử thì ta chỉ nhận biết được dung dịch Na2CO3 do có phản ứng với dung dịch BaCl2 tạo kết tủa trắng:
BaCl2 + Na2CO3 BaCO3+ 2NaCl
B. Sử dụng dung dịch Ba(OH)2 làm thuốc thử thì ta nhận biết được các chất như sau:
+ Dung dịch phản ứng với thuốc thử làm xuất hiện kết tủa trắng là Na2CO3:
Na2CO3 + Ba(OH)2 BaCO3+ 2NaOH
+ Dung dịch phản ứng với thuốc thử giải phóng khí mùi khai là NH4NO3:
![]()
+ Dung dịch mà khi cho thuốc thử vào chuyển sang màu đỏ là phenolphatlein.
+ Dung dịch mà khi cho thuốc thử vào không có hiện tượng là NaNO3.
C. Sử dụng dung dịch HCl làm thuốc thử thì ta chỉ nhận biết được dung dịch Na2CO3 do khi tác dụng với dung dịch HCl giải phóng khí không màu: Na2CO3 + 2HCl 2NaCl + CO2 + H2O.
Với đáp án A và C; sau khi cùng nhận biết được dung dịch Na2CO3 thì có thể dùng dung dịch Na2CO3 để nhận biết dung dịch phenolphtalein (do dung dịch Na2CO3 có tính kiềm) nhưng không thể tiếp tục nhận biết hai dung dịch còn lại là NH4NO3 và NaNO3.
Câu 28:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Do có phản ứng:
4Ag + 2H2S + O2 → 2H2O + 2Ag2Sđen
Câu 30:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Thủy ngân tác dụng với lưu huỳnh ngay tại điều kiện thường:
Hg + S → HgS↓
Do đó khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là lưu huỳnh.
HgS là chất rất bền, khó tan trong axit nên đươc thu gom lại dễ dàng.
Có thể bạn quan tâm
- Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ (có đáp án) (463 lượt thi)
- 15 Câu trắc nghiệm luyện tập nhận biết một số chất vô cơ, chuẩn độ dung dịch có đáp án (275 lượt thi)
- Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án (Nhận biết) (268 lượt thi)
- Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án (Thông hiểu) (254 lượt thi)
- Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án (Vận dụng) (262 lượt thi)
Các bài thi hot trong chương
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ cơ bản (406 lượt thi)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ nâng cao (404 lượt thi)
- Trắc nghiệm Nhận biết một số chất khí (có đáp án) (394 lượt thi)
- Trắc nghiệm Nhận biết một số ion trong dung dịch (có đáp án) (381 lượt thi)
- Trắc nghiệm Nhận biết một số ion trong dung dịch có đáp án (Thông hiểu) (293 lượt thi)
- Trắc nghiệm Nhận biết một số ion trong dung dịch có đáp án (Nhận biết) (254 lượt thi)
- Trắc nghiệm Nhận biết một số chất khí có đáp án (Thông hiểu) (242 lượt thi)
- Trắc nghiệm Nhận biết một số chất khí có đáp án (Nhận biết) (238 lượt thi)
- Trắc nghiệm Hóa 12 Bài 41 (có đáp án): Nhận biết một số chất khí (234 lượt thi)
- Trắc nghiệm Nhận biết một số ion trong dung dịch có đáp án (Vận dụng) (222 lượt thi)
