Trắc nghiệm Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án)
Trắc nghiệm Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
-
471 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
A. H2S ⇄
B. H2O
C. Mg(OH)2
D. K2CO3
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Chất điện li mạnh bao gồm: axit mạnh, bazơ mạnh và hầu hết các muối.
→ NaCl, HCl, NaOH là chất điện li mạnh.
Câu 3:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Muối trung hòa là muối không có khả năng phân li ra H+.
Câu 4:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Al(OH)3 có tính lưỡng tính vì vừa tác dụng với axit và bazơ
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
Câu 5:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A, D là muối trung hòa
C là bazơ
B là muối axit vì gốc axit có khả năng phân li ra ion H+.
Câu 7:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
không phân li
Câu 8:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
- Loại A vì
- Loại B vì
- Loại C vì
Câu 10:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Chất điện li: là chất mà khi tan trong nước, các phân tử hòa tan đều phân li hoàn toàn ra ion.
→ chỉ có KCl trong các chất trong dãy là chất điện li (chất điện li mạnh).
Câu 11:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Giả sử ion Y có dạng
Áp dụng định luật bảo toàn điện tích ta có:
+ n = 1 → a = 0,03 → A, D thỏa mãn nhưng các ion không được phản ứng với nhau → loại A vì
→ D thỏa mãn.
Câu 12:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
C2H5OH không phải chất điện li vì ancol etylic tan trong nước nhưng không phân li thành các ion.
Câu 13:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
B loại vì HF là chất điện li yếu và C6H6 không là chất điện li.
C loại vì H2S là chất điện li yếu.
D loại vì H2S là chất điện li yếu.
Câu 14:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
A loại vì
B loại vì
D loại vì và
Câu 15:
20/07/2024Cho các phương trình sau :
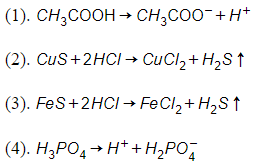
Số phương trình được viết đúng là :
 Xem đáp án
Xem đáp án
Đáp án A
(1) sai
(2) sai vì không xảy ra phản ứng.
(3) đúng
(4) sai
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Vì có Mg2+ nên dung dịch không có OH-
→ Loại B và C.
→ Y- là
Áp dụng định luật bảo toàn điện tích ta có :
0,1.1 + 0,2.2 + 0,1. 1 = 0,2.1 + a.1
→ a = 0,4 mol
Câu 17:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Câu 19:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
HCl →
Khi thêm vài giọt dung dịch HCl vào
→ [H+] tăng
→ Cân bằng dịch chuyển sang trái
→ Độ điện li giảm
Câu 20:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
KOH + HCl → KCl + H2O
Giả sử KOH phản ứng hết
→
→ Giả sử sai
→ KOH dư, HCl hết
Gọi nồng độ của axit HCl là a (mol/l)
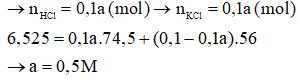
Câu 21:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
B loại vì
C loại vì và
D loại vì
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
100 ml dung dịch HCl có pH = 1
→ [H+] = 0,1M
→
Sau khi trộn thu được 200ml dung dịch có pH = 12 > 7
→ H+ hết, OH- dư
pOH = 2→ [OH-] = 0,01M
→ dư = 0,01.0,2 = 0,002 mol
→ 0,002 = 0,1.(0,1 + a) – 0,01
→ a = 0,02 M
Câu 23:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Hiện tượng khi cho khoảng 2 ml dung dịch Na2CO3 đặc vào ống nghiệm đựng khoảng 2 ml dung dịch CaCl2 là xuất hiện kết tủa trắng.
Câu 24:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Câu 25:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Ba(HCO3)2 + Na2CO3 → BaCO3↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4↓ + K2SO4 + CO2↑ + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3↓ + CaCO3↓ + 2 H2O
Ba(HCO3)2 + H2SO4 → BaSO4↓ + 2CO2↑ + 2H2O
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Chất điện li yếu là chất tan trong nước nhưng chỉ một phần bị phân li thành ion.
→ Chất điện li yếu gồm: H2O và CH3COOH
Câu 27:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Hiện tượng khi hòa tan CaCO3 bằng dung dịch HCl loãng là thấy xuất hiện bọt khí không màu.
Phương trình ion thu gọn:
CaCO3
Câu 28:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
- Axit CH3COOH là axit yếu → quỳ tím chuyển sang màu hồng
CH3COOH
- NH3 có tính bazơ yếu
NH3 + H2O
→ Quỳ tím chuyển sang màu xanh nhạt do nồng độ OH- thấp.
- NaOH là bazơ mạnh
NaOH →
→ Quỳ tím chuyển sang màu xanh đậm hơn.
Câu 29:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Áp dụng định luật bảo toàn điện tích ta có:
Tổng số mol điện tích cation = Tổng số mol điện tích anion
→ a + 2b = 2c + d
Câu 30:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Gọi V, V’ lần lượt là thể tích dung dịch axit HCl trước và sau pha loãng.
Trước khi pha loãng có pH = 3
→ [ H+] =
→
Sau khi pha loãng có pH = 4
→ [ H+] =
→
Mà số mol H+ không đổi
→
→ Cần pha loãng gấp 10 lần.
Có thể bạn quan tâm
- Trắc nghiệm Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (470 lượt thi)
- 16 câu trắc nghiệm Axit, bazơ và muối Phản ứng trao đổi ion trong dung dịch các chất điện li cực hay (343 lượt thi)
Các bài thi hot trong chương
- 100 câu trắc nghiệm Sự điện li nâng cao (1732 lượt thi)
- 100 câu trắc nghiệm Sự điện li cơ bản (1433 lượt thi)
- Trắc nghiệm Axit, bazơ và muối (có đáp án) (789 lượt thi)
- Trắc nghiệm Sự điện li (có đáp án) (725 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (có đáp án) (717 lượt thi)
- 15 câu trắc nghiệm Axit, bazơ, muối cực hay có đáp án (590 lượt thi)
- Trắc nghiệm Axit, bazơ và muối có đáp án (Thông hiểu) (471 lượt thi)
- 15 câu trắc nghiệm Sự điện li cực hay có đáp án (403 lượt thi)
- Trắc nghiệm Sự điện li có đáp án (Vận dụng) (395 lượt thi)
- Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (395 lượt thi)
