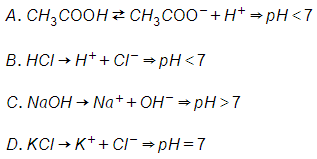Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (có đáp án)
Trắc nghiệm Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
-
659 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
HCl là một axit mạnh, điện li hoàn toàn nên ta có:
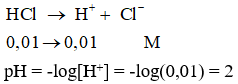
Câu 3:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
H2SO4, HCl là axit
→ pH < 7, trong đó pH của axit H2SO4 < pH của axit HCl vì nồng độ H lớn hơn khi hai axit cùng nồng độ.
KNO3 là muối trung hòa tạo bởi kim loại mạnh và gốc axit mạnh
→ pH = 7
Dung dịch Na2CO3 có môi trường bazơ do tạo bởi kim loại mạnh và gốc axit yếu
→ pH > 7
→ Giá trị pH tăng dần: (2), (3), (4), (1).
Câu 4:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
pH tăng → nồng độ [H+] giảm
→ độ axit giảm.
Câu 5:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
HNO3 là axit mạnh → là chất điện li mạnh → phân li hoàn toàn ra ion.
HNO2 là axit yếu → là chất điện li yếu → phân li không hoàn toàn ra ion.
→ [ ] của HNO3 > [ ] của HNO2.
Câu 6:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
[ ] =
→ pH = 14 + lg[ ] = 11,62
Câu 7:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
a lít dung dịch KOH có pH = 12
→ [ ] = 0,01M
→
8 lít dung dịch HCl có pH = 3
→ [ ] = 0,001M
→
Sau khi trộn thu được dung dịch Y có pH =11
→ [ ] = 0,001M
→
→ 0,001(a + 8) = 0,01a – 0,008
→ a = 1,78
Câu 8:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
H2SO4
→ [H+] = 0,2M
→ pH = lg[H+] = 0,7
Câu 9:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
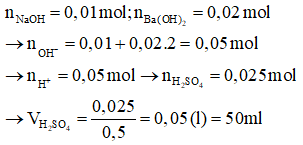
Câu 10:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
pH = 5 → [] = 10-5 M
Câu 11:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Trung hòa vừa đủ
→
→ 0,5.(1,98 + 2.1,1) = V.(3 + 4.2)
→ V = 0,19 lít
Câu 12:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi V, V’ lần lượt là thể tích dung dịch axit HCl trước và sau pha loãng.
Trước khi pha loãng có pH = 3
→ [] =
→
Sau khi pha loãng có pH = 4
→ [] =
→
Mà số mol không đổi
→
→ Cần pha loãng gấp 10 lần.
Câu 13:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
pH = 4,82
→ [H+] = >
Câu 14:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
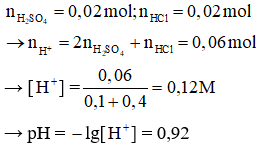
Câu 15:
22/07/2024Dung dịch NaOH có pH = 12. Cần pha loãng dung dịch này bao nhiêu lần để thu được dung dịch NaOH mới có pH = 11?
 Xem đáp án
Xem đáp án
Đáp án A
Gọi V, V’ lần lượt là thể tích dung dịch NaOH trước và sau pha loãng.
- Trước khi pha loãng có pH = 12
→ pOH = 2
→ [OH-] =
→
- Sau khi pha loãng có pH = 11
→ pOH = 3
→ [OH-] =
→
Mà số mol OH- không đổi
→
→ Cần pha loãng gấp 10 lần.
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
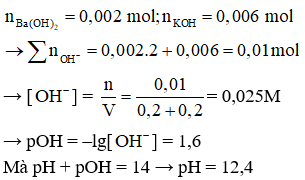
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
NaOH + HCl → NaCl + H2O
→ Dung dịch chứa muối NaCl và HCl dư.
→ [ ] dư =
pH = lg[] = 2
Câu 18:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi V, V’ lần lượt là thể tích dung dịch axit HCl trước và sau pha loãng.
Trước khi pha loãng có pH = 2
→ [ ] =
→
Sau khi pha loãng có pH = 4
→ [ ] =
→
Mà số mol không đổi
→
→ Cần pha loãng gấp 100 lần.
Câu 19:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
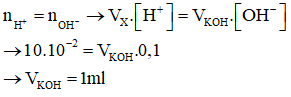
Câu 20:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
[H+] = 1,5.10-4M >
→ Dung dịch có môi trường axit.
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi V, V’ lần lượt là thể tích dung dịch KOH trước và sau pha loãng.
Trước khi pha loãng có pH = 13
→ pOH = 1
→ [] =
→
Sau khi pha loãng có pH = 11
→ pOH = 3
→ [] =
→
Mà số mol không đổi
→
→ Cần pha loãng gấp 100 lần.
Câu 23:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
→ [ H+] = [ ] < 0,1M
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
→ Dung dịch sau phản ứng có môi trường axit.
→ Quỳ tím chuyển sang màu đỏ.
Câu 25:
23/07/2024Để trung hoà 100 gam dung dịch HCl 1,825% cần bao nhiêu ml dung dịch Ba(OH)2 có pH bằng 13?
 Xem đáp án
Xem đáp án
Đáp án A
Dung dịch trung hòa axit có pH = 13 → pOH = 1
→ [OH-] =
→
→ 0,05 = 0,1V
→ V = 0,5 lít = 500ml
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
- Dung dịch sau khi trộn có pH = 12
→ axit phản ứng hết, kiềm dư.

Câu 27:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Các dung dịch HCl; H2SO4; CH3COOH có cùng giá trị pH → [H+] trong các dung dịch là như nhau (đặt là aM)
Ta có:
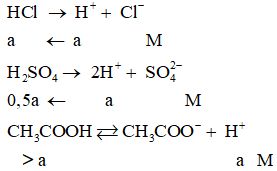
Do CH3COOH là chất điện li yếu nên nồng độ ban đầu của CH3COOH > a (M).
Vậy nồng độ mol của H2SO4 < HCl < CH3COOH
Câu 28:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Khi nhỏ dung dịch phenolphtalein vào dung dịch NaOH loãng → dung dịch có màu hồng.
Nhỏ tiếp từ từ dung dịch HCl loãng đến dư → dung dịch chuyển từ màu hồng sang không màu.
Câu 29:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương trình hóa học:
Ba(HCO3)2 + NaHSO4 → BaSO4↓ + NaHCO3 + CO2↑ + H2O
→ Các ion có mặt trong dung dịch Y là .
Câu 30:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Muối Na2CO3 tạo bởi cation của kim loại mạnh và anion của gốc axit yếu nên có hiện tượng thủy phân của gốc axit tạo môi trường bazơ → quỳ tím hóa xanh.
Na2CO3 →
Có thể bạn quan tâm
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (có đáp án) (658 lượt thi)
- 15 câu trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit - bazơ cực hay có đáp án (299 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ có đáp án (Nhận biết) (270 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ có đáp án (Thông hiểu) (305 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ có đáp án (Vận dụng) (235 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ có đáp án (Tổng hợp) (271 lượt thi)
Các bài thi hot trong chương
- 100 câu trắc nghiệm Sự điện li nâng cao (1492 lượt thi)
- 100 câu trắc nghiệm Sự điện li cơ bản (1232 lượt thi)
- Trắc nghiệm Axit, bazơ và muối (có đáp án) (728 lượt thi)
- Trắc nghiệm Sự điện li (có đáp án) (665 lượt thi)
- 15 câu trắc nghiệm Axit, bazơ, muối cực hay có đáp án (541 lượt thi)
- Trắc nghiệm Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (416 lượt thi)
- Trắc nghiệm Axit, bazơ và muối có đáp án (Thông hiểu) (414 lượt thi)
- Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (354 lượt thi)
- Trắc nghiệm Sự điện li có đáp án (Vận dụng) (353 lượt thi)
- 15 câu trắc nghiệm Sự điện li cực hay có đáp án (345 lượt thi)