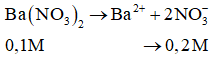Trắc nghiệm Axit, bazơ và muối (có đáp án)
Trắc nghiệm Bài 2: Axit, Bazơ, Muối
-
729 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Muối trung hòa là muối mà gốc axit không có khả năng phân li ra .
Câu 2:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Axit 1 nấc là axit trong dung dịch chỉ phân li một nấc ra ion .
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
A sai vì theo thuyết A-rê-ni-ut muối là những hợp chất khi tan trong nước phân li ra cation kim loại hoặc cation và anion gốc axit.
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Các hiđroxit lưỡng tính thường gặp là Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2, Cu(OH)2, Cr(OH)2.
Câu 5:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
NaOH + HNO3 → NaNO3 + H2O
Giả sử NaOH phản ứng hết
→ Giả sử sai
→ HNO3 hết, NaOH dư
nNaOH dư = 0,1- 0,1x (mol)
Câu 6:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Theo thuyết A-rê-ni-ut, bazơ là chất khi tan trong nước phân li cho anion .
Câu 7:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Các hiđroxit lưỡng tính thường gặp là Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2.
Câu 8:
23/07/2024Cần bao nhiêu ml dung dịch NaOH 0,5M để phản ứng vừa đủ với 50 ml dung dịch NaHCO3 0,2M ?
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
NaOH + NaHCO3 → Na2CO3 + H2O
→ VNaOH = 20 ml.
Câu 9:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn điện tích ta có:
= 0,55 mol.
Bảo toàn khối lượng muối ta có:
mMuối = 0,1.64 + 0,3.35,5 + 1,2.23 + 0,55.96 = 97,45 gam.
Câu 10:
04/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Nhôm hiđroxit có tính lưỡng tính vì vừa tác dụng với axit vừa tác dụng với bazơ.
Câu 11:
02/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Vì NaHSO4 có khả năng phân li ra ion
Câu 12:
16/07/2024Dung dịch X chứa m gam ba ion: Mg2+, NH4+, SO42-. Chia dung dịch X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch KOH dư thu được 5,8 gam kết tủa. Phần 2 đun nóng với dung dịch NaOH dư thu được 3,36 lít khí (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch X chứa 2 muối MgSO4 và (NH4)2SO4
- Phần 1: tác dụng với KOH
(NH4)2SO4 + 2KOH → 2NH3↑ + K2SO4 + 2H2O
MgSO4 + 2KOH → Mg(OH)2↓ + K2SO4
- Phần 2: tác dụng với NaOH
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + 2H2O
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
Câu 13:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn điện tích ta có:
mmuối = mcation + manion
→ mmuối = 0,35.23 + 0,15.39 + 0,1.61 + 0,15.60 + 0,05.96 = 33,8 gam
Câu 14:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn điện tích ta có:
Bảo toàn khối lượng muối ta có:
mmuối = mcation + manion
Từ (1) và (2)
→ x = 0,2 mol; y = 0,1 mol
Câu 15:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Các hiđroxit lưỡng tính thường gặp là Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2, Cu(OH)2, Cr(OH)2.
Câu 16:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch của chất A làm qùy tím ngả màu xanh → dung dịch A là có môi trường bazơ.
Dung dịch của chất B không làm qùy tím đổi màu → B là có môi trường trung tính.
Trộn 2 dung dịch A và B xuất hiện kết tủa → Đáp án B thỏa mãn
K2CO3 + Ba(NO3)2 → BaCO3 ↓ + 2KNO3
Chú ý: Học sinh cần nắm được phản ứng thủy phân của muối.
K2CO3 là muối trung hòa tạo bởi kim loại mạnh và gốc axit yếu nên làm quỳ tím chuyển sang màu xanh.
Câu 17:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Zn(OH)2 là hiđroxit lưỡng tính → trong nước Zn(OH)2 vừa phân li theo kiểu bazơ vừa theo kiểu axit.
Câu 18:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch NaCl không làm quỳ tím đổi màu.
Dung dịch NaOH, Na2CO3 làm quỳ tím hóa xanh.
Dung dịch NH4Cl làm quỳ tím hóa đỏ.
Câu 19:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Thuốc thử : NaOH dư
Hiện tượng :
+ Có khí mùi khai: NH4Cl
NH4Cl + NaOH → NH3↑ + NaCl + H2O
+ Xuất hiện kết tủa màu nâu đỏ: FeCl3
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
+ Xuất hiện kết tủa màu xanh: Cu(NO3)2
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
+ Ban đầu kết hiện kết tủa trắng dạng keo, cho NaOH dư thì kết tủa tan: AlCl3
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3↓ + NaOH → Na[Al(OH)4]
+ Không hiện tượng: KNO3
Câu 20:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
→ Khí amoniac làm giấy quỳ tím ẩm chuyển sang màu xanh.
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
→
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Nhận thấy:
→ phản ứng xảy ra vừa đủ tạo ra muối K2HPO4
2KOH + H3PO4 → K2HPO4 + 2H2O
→ mmuối = 0,08. 174 = 13,92 gam.
Câu 23:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
2KOH + MgCl2 → Mg(OH)2↓ + 2KCl
→
→
Câu 24:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Axit điện li mạnh: HCl, H2SO4
Cùng nồng độ mol thì dung dịch H2SO4 có nồng độ là lớn nhất.
HCl →
Câu 26:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Ca(OH)2 không phải hiđroxit lưỡng tính vì chỉ có thể phân li theo kiểu bazơ
Ca(OH)2 →
Câu 27:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Áp dụng định luật bảo toàn điện tích ta có:
Câu 28:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Khi cho từ từ dung dịch kiềm vào dung dịch ZnSO4 cho đến dư thì xuất hiện kết tủa sau kết tủa tan dần
ZnSO4 + 2NaOH → Zn(OH)2↓ + Na2SO4
Zn(OH)2↓ + 2NaOH → Na2[Zn(OH)4]
Câu 29:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
A sai vì theo thuyết A-rê-ni-ut, axit là chất khi tan trong nước phân li ra ion.
B sai vì theo thuyết A-rê-ni-ut, bazơ là chất khi tan trong nước phân li ra ion.
C đúng.
D sai vì theo thuyết A-rê-ni-ut, bazơ là chất khi tan trong nước phân li ra ion
→ Phải có nhóm -OH.
Câu 30:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Các hiđroxit lưỡng tính thì có tính axit và bazơ yếu.
Có thể bạn quan tâm
- Trắc nghiệm Axit, bazơ và muối (có đáp án) (728 lượt thi)
- 15 câu trắc nghiệm Axit, bazơ, muối cực hay có đáp án (544 lượt thi)
- Trắc nghiệm Axit, bazơ và muối có đáp án (Nhận biết) (275 lượt thi)
- Trắc nghiệm Axit, bazơ và muối có đáp án (Thông hiểu) (415 lượt thi)
- Trắc nghiệm Axit, bazơ và muối có đáp án (Vận dụng) (325 lượt thi)
Các bài thi hot trong chương
- 100 câu trắc nghiệm Sự điện li nâng cao (1494 lượt thi)
- 100 câu trắc nghiệm Sự điện li cơ bản (1239 lượt thi)
- Trắc nghiệm Sự điện li (có đáp án) (668 lượt thi)
- Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit-bazơ (có đáp án) (660 lượt thi)
- Trắc nghiệm Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (417 lượt thi)
- Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án) (355 lượt thi)
- Trắc nghiệm Sự điện li có đáp án (Vận dụng) (354 lượt thi)
- 15 câu trắc nghiệm Sự điện li cực hay có đáp án (346 lượt thi)
- Trắc nghiệm Ôn tập Hóa học 11 Chương 1 có đáp án (Thông hiểu) (341 lượt thi)
- Trắc nghiệm Sự điện li có đáp án (328 lượt thi)