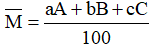Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án
Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án (Đề 1)
-
249 lượt thi
-
31 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử trung hòa vì điện vì có tổng số hạt electron (mang điện tích âm) bằng tổng số hạt proton (mang điện tích dương).
Câu 2:
20/07/2024Một loại nguyên tử potassium có 19 proton, 19 electron và 20 neutron. Số khối của nguyên tử này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số khối (A) = số proton (Z) + số neutron (N) = 19 + 20 = 39.
Câu 3:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phát biểu B sai vì nguyên tử có cấu trúc rỗng.
Câu 4:
21/10/2024Trong tự nhiên, đồng (copper) có hai đồng vị bền là và . Nguyên tử khối trung bình của đồng là 63,54. Phần trăm số nguyên tử của đồng vị là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
*Phương pháp giải:
Ta có: Nguyên tử khối trung bình của đồng là 63,54 và đồng có 2 đồng vị là 63Cu và 65Cu
- gọi phần trăm số nguyên tử của 1 đồng vị là x thì đồng vị còn lại sẽ là 100-x
- áp dụng công thức nguyên tử khối trung bình ta sẽ tìm ra được x
*Lời giải:
Gọi phần trăm số nguyên tử của là x%
⇒ Phần trăm số nguyên tử của là 100 – x %
Ta có:
Phần trăm số nguyên tử của đồng vị là 73%.
* Lý thuyết cần nắm và dạng bài tập về tính nguyên tử khối trung bình, xác định phần trăm các đồng vị,..:
- Áp dụng công thức tính nguyên tử khối trung bình:
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
- Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Giả sử nguyên tố R có 2 hai đồng vị A và B với số khối tương ứng là A và B
a, b là phần trăm tương ứng của 2 đồng vị trong tự nhiên.
Ta có: a + b = 100 hay b = 100 – a.
Thay vào công thức tính nguyên tử khối trung bình:
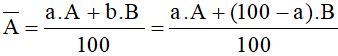
Từ đó giải ra được a và b.
Xem thêm các bài viết liên quan hay, chi tiết:
Câu 5:
07/07/2024Cặp nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
thuộc cùng một nguyên tố hóa học do có cùng số proton là 8
Câu 6:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số orbital trong các phân lớp s, p, d lần lượt là 1, 3, 5.
Câu 7:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp M (n = 3) có số electron tối đa là 2.32 = 2.9 = 18.
Câu 8:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình theo ô orbital của calcium như sau:
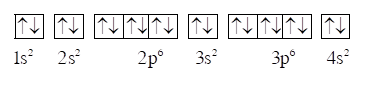
Vậy nguyên tử calcium không có electron độc thân.
Câu 9:
10/07/2024Cho các cấu hình electron sau:
(1) 1s22s1
(2) 1s22s22p4
(3) 1s22s22p63s23p63d104s24p5
(4) 1s22s22p63s23p1
Số cấu hình electron của nguyên tố phi kim là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
(1) 1s22s1 là kim loại do có 1 electron ở lớp ngoài cùng.
(2) 1s22s22p4 là phi kim do có 6 electron ở lớp ngoài cùng.
(3) 1s22s22p63s23p63d104s24p5 là phi kim do có 7 electron ở lớp ngoài cùng.
(4) 1s22s22p63s23p1 là kim loại do có 3 electron ở lớp ngoài cùng.
Câu 10:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bảng tuần hoàn gồm có 7 chu kì, trong đó có 3 chu kì nhỏ và 4 chu kì lớn.
Câu 11:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi số hạt proton, neutron và electron có trong Y lần lượt là P, N và E (trong đó P = E).
Theo bài ra ta có hệ phương trình:
Cấu hình electron của Y: 1s22s22p63s1.
Vậy Y ở ô thứ 11 (do Z = P = E = 11); chu kì 3 (do có 3 lớp electron), nhóm IA (do 1 electron hóa trị, nguyên tố s).
Câu 12:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong một nhóm A, theo chiều từ trên xuống dưới, bán kính nguyên tử của các nguyên tố tăng dần.
Câu 13:
17/07/2024Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phát biểu B sai vì: Trong một nhóm A, khi điện tích hạt nhân tăng lên thì độ âm điện giảm.
Câu 14:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Al2O3 là oxide lưỡng tính.
Câu 15:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử nguyên tố R (Z = 15): [Ne]3s23p3.
Vậy R thuộc nhóm VA, công thức oxide cao nhất là R2O5.
Câu 16:
10/07/2024Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X ở chu kì 3 Þ có 3 lớp electron.
X ở nhóm IIA Þ có 2 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử nguyên tố X: 1s²2s²2p63s².
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron bền vững là cấu hình electron như khí hiếm với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
Chọn T (Z = 18): 1s²2s²2p3s²3p6 do có 8 electron ở lớp ngoài cùng.
Câu 18:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
O (Z = 8): 1s22s22p4.
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận vào 2 electron khi hình thành liên kết hóa học.
Câu 19:
04/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Quá trình đúng:
Câu 20:
17/07/2024Cho các phát biểu sau về hợp chất ion:
(a) Không dẫn điện khi nóng chảy.
(b) Khá mềm.
(c) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(d) Khó tan trong nước và các dung môi phân cực.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu đúng là (c). Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Câu 21:
14/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết σ là liên kết được hình thành do sự xen phủ trục của hai orbital.
Câu 22:
23/07/2024Cho dãy các chất: O2, H2, NH3, KCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực: O2; H2.
Câu 23:
13/07/2024Công thức Lewis của SO2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết và các electron hóa trị riêng.
Công thức Lewis của SO2 là: 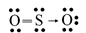
Câu 24:
17/07/2024Liên kết hóa học giữa các nguyên tử trong phân tử CH4 là loại liên kết nào sau đây (biết độ âm điện của nguyên tử H là 2,2 và C là 2,55)?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ta có:
∆χ = 2,55 – 2,2 = 0,35 < 0,4
Vậy liên kết hóa học giữa C và H trong phân tử CH4 là liên kết cộng hóa trị không phân cực.
Câu 25:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
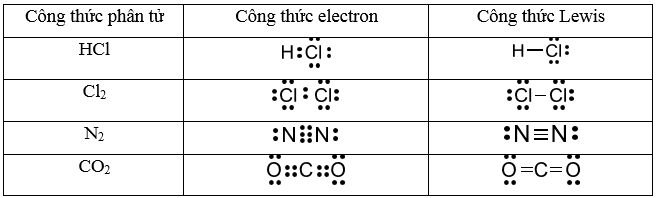
HCl, CO2 là các hợp chất cộng hóa trị.
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức Lewis của SiH4:
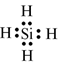
Phân tử SiH4 không có cặp electron hóa trị riêng.
Câu 27:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tương tác van der Waals tồn tại giữa những phân tử.
Câu 28:
22/07/2024Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Sơ đồ thể hiện liên kết hydrogen giữa hai phân tử HF:
Câu 30:
22/07/2024Viết hai giai đoạn của sự hình thành LiCl từ các nguyên tử tương ứng (kèm theo cấu hình electron). Biết Li (Z = 3); Cl (Z = 17).
 Xem đáp án
Xem đáp án
Quá trình hình thành liên kết ion diễn ra như sau:
- Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
Li → Li+ + 1e
Số electron trên các lớp: 2, 1 2
Cấu hình electron: [He]2s1 [He]
Cl + 1e → Cl-
Số electron trên các lớp: 2, 8, 7 2, 8, 8
Cấu hình electron: [Ne]3s23p5 [Ar]
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
Li+ + Cl- → LiCl
Câu 31:
23/07/2024Khối lượng phân tử (amu) của nước, ammonia và methane lần lượt bằng 18, 17 và 16. Nước sôi ở 100 oC, ammonia sôi ở –33,35 oC và methane sôi ở –161,58 oC. Giải thích vì sao các chất trên có khối lượng phân tử xấp xỉ nhau nhưng nhiệt độ sôi của chúng lại chênh lệch nhau.
 Xem đáp án
Xem đáp án
Nhiệt độ sôi của nước (H2O) lớn hơn rất nhiều so với ammonia (NH3) và methane (CH4) vì phân tử H2O và NH3 có liên kết hydrogen trong phân tử (còn CH4 không có); do độ âm đện O > N nên liên kết hydrogen trong H2O bền hơn trong NH3.
Bài thi liên quan
-
Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án (Đề 2)
-
32 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề kiểm tra giữa học kì 1 Hóa học 10 CD có đáp án (250 lượt thi)
- Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án (248 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra Giữa học kì 2 Hóa 10 Cánh diều có đáp án (1086 lượt thi)