Lý thuyết Nguyên tố nhóm IIA– Hóa lớp 12 Cánh diều
Với lý thuyết Hóa lớp 12 Bài 18: Nguyên tố nhóm IIA chi tiết, ngắn gọn và bài tập tự luyện có lời giải chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm để học tốt môn Hóa 12.
Lý thuyết Hóa 12 Bài 18: Nguyên tố nhóm IIA- Cánh diều
A. Lý thuyết Nguyên tố nhóm IIA
I. Trạng thái tự nhiên
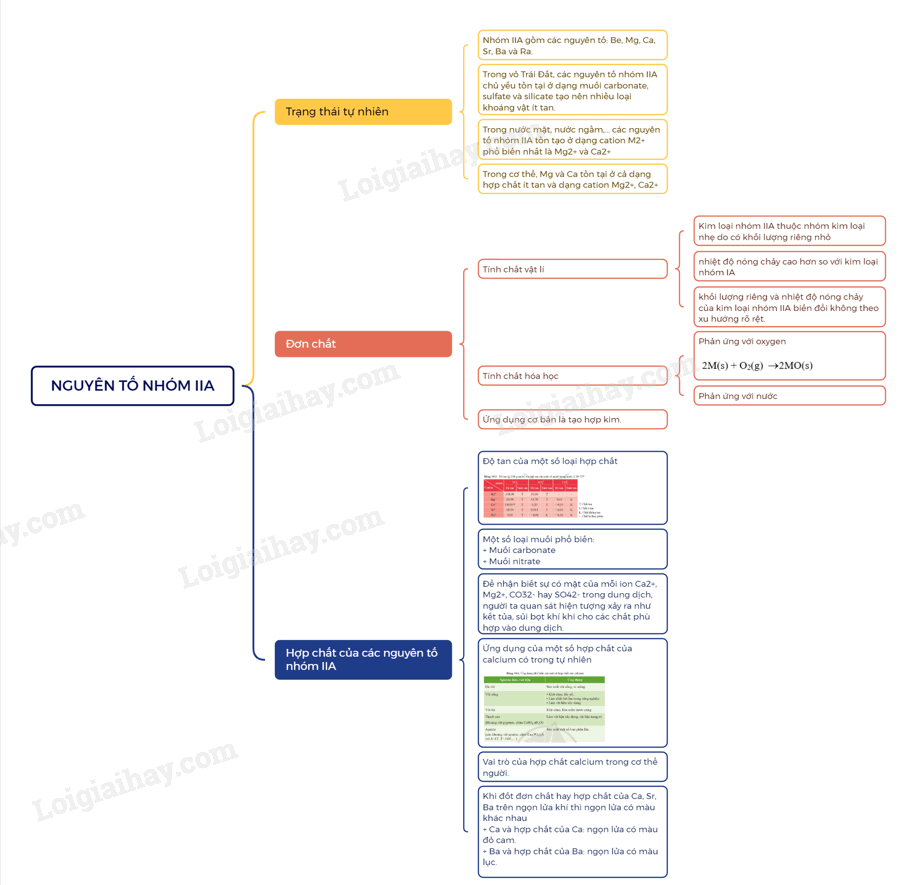
- Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra.
- Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối carbonate, sulfate và silicate tạo nên nhiều loại khoáng vật ít tan.
- Trong nước mặt, nước ngầm,… các nguyên tố nhóm IIA tồn tạo ở dạng cation M2+ phổ biến nhất là Mg2+ và Ca2+
- Trong cơ thể, Mg và Ca tồn tại ở cả dạng hợp chất ít tan và dạng cation Mg2+, Ca2+
II. Đơn chất
1. Tính chất vật lí
- Bán kính nguyên tử và một số tính chất vật lí của kim loại nhóm IIA được thể hiện qua bảng sau:
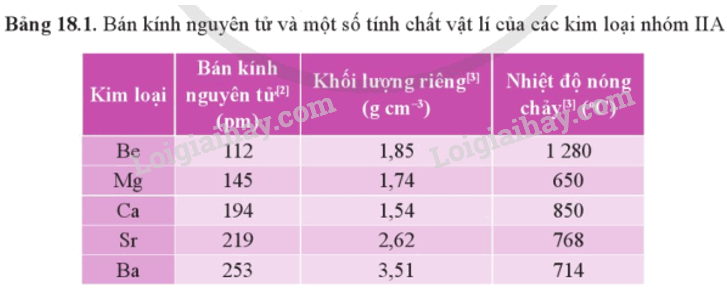
- Kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA, nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hóa học
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
III. Hợp chất của các nguyên tố nhóm IIA
1. Độ tan của một số loại hợp chất
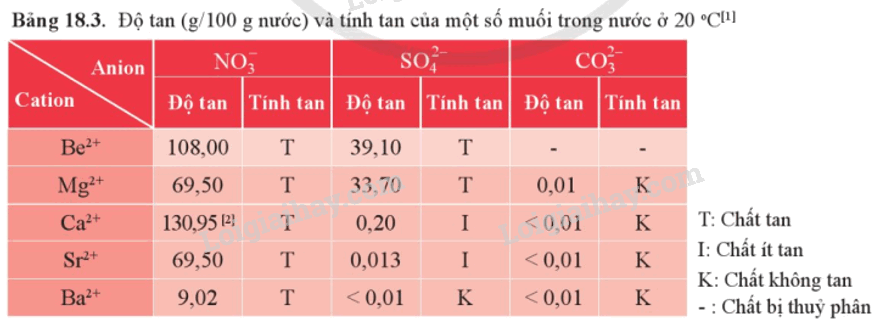
2. Một số loại muối phổ biến
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
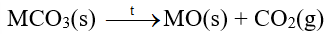
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
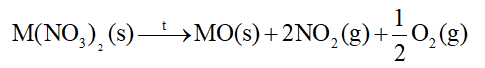
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, CO32- hay SO42- trong dung dịch, người ta quan sát hiện tượng xảy ra như kết tủa, sủi bọt khí khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp chất của calcium có trong tự nhiên
thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.

b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
+ Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
+ Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp.
IV. Nhận biết kim loại và ion kim loại nhóm IIA
Khi đốt đơn chất hay hợp chất của Ca, Sr, Ba trên ngọn lửa khí thì ngọn lửa có màu khác nhau
+ Ca và hợp chất của Ca: ngọn lửa có màu đỏ cam.
+ Ba và hợp chất của Ba: ngọn lửa có màu lục.
B. Trắc nghiệm Nguyên tố nhóm IIA
Đang cập nhật …
C. Sơ đồ tư duy nhóm IIA
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều
