Lý thuyết Nguồn điện hoá học– Hóa lớp 12 Cánh diều
Với lý thuyết Hóa lớp 12 Bài 11: Nguồn điện hoá học chi tiết, ngắn gọn và bài tập tự luyện có lời giải chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm để học tốt môn Hóa 12.
Lý thuyết Hóa 12 Bài 11: Nguồn điện hoá học- Cánh diều
A. Lý thuyết Nguồn điện hoá học
I. Cấu tạo và nguyên tắc hoạt động của Pin Galvani
1. Cấu tạo
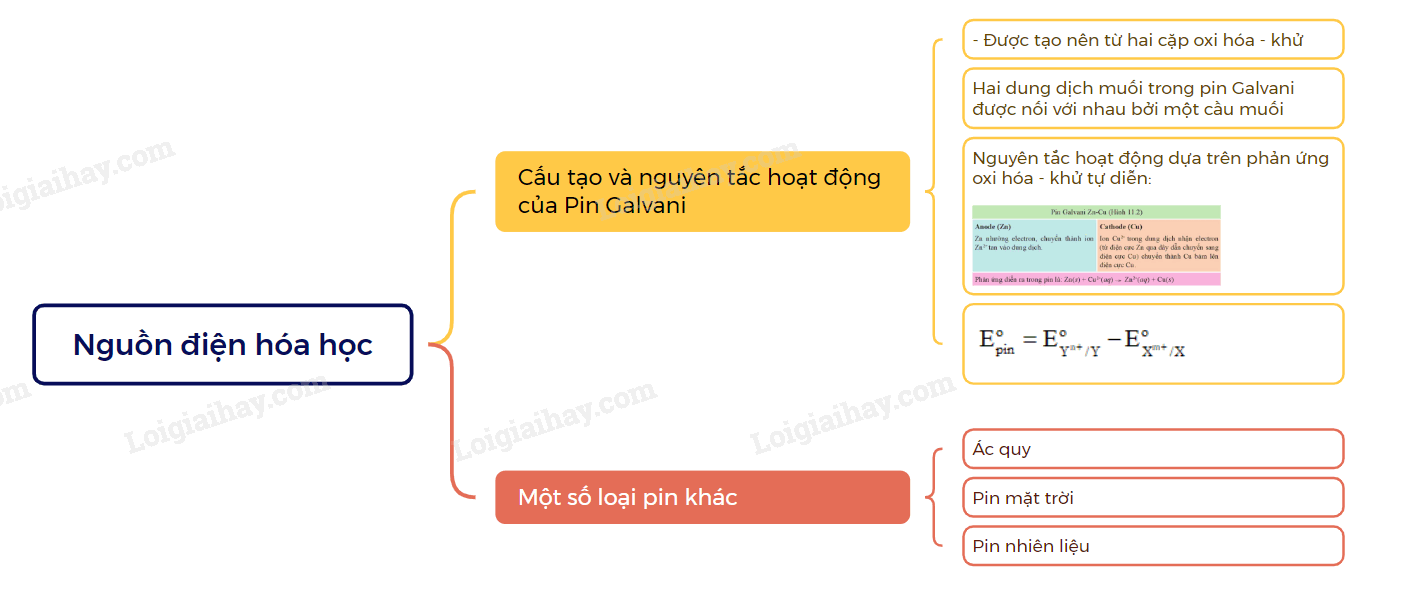
Một pin Galvani được tạo nên từ hai cặp oxi hóa – khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu) thường có cấu tạo như sau:
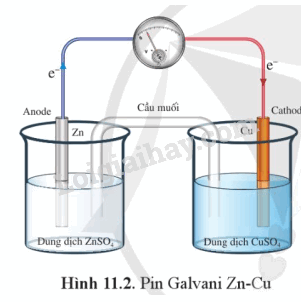
Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối.
2. Nguyên tắc hoạt động
Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
Ví dụ:

3. Sức điện động của pin điện hóa
Sức điện động chuẩn cuẩ pin () tạo từ hai cặp oxi hóa – khử Xm+/X và Yn+/Y (trong đó ) được tính theo công thức sau:
II. Giới thiệu một số loại pin thông dụng khác
1. Acquy
Acquy là một loại pin có thể tái sử dụng nhiều lần bằng cách sạc điện. Acquy thường được phân loại dựa theo bản chất vật liệu làm điện cực.
2. Pin nhiên liệu
Pin nhiên liệu là loại pin biến đổi trực tiếp năng lượng hóa học (hóa năng) thành điện năng nhờ quá trình oxi hóa gián tiếp nhiên liệu diễn ra trong pin. Chất oxi hóa thường dùng trong pin nhiên liệu là oxygen
3. Pin mặt trời
Pin mặt trời là loại pin biến đổi trực tiếp quang năng thành điện năng.
B. Trắc nghiệm Nguồn điện hoá học
Đang cập nhật …
C. Sơ đồ tư duy Nguồn điện hóa học
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều
