Trắc nghiệm Tính chất hóa học của kim loại (có đáp án)
Trắc nghiệm Hóa học 9 Bài 16: Tính chất hóa học của kim loại
-
257 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Dãy gồm các dung dịch muối tác dụng được với kim loại Mg là
 Xem đáp án
Xem đáp án
Đáp án A
Kim loại hoạt động hóa học mạnh hơn sẽ đẩy kim loại hoạt động yếu hơn ra khỏi muối.
Mg + ZnCl2 → MgCl2 + Zn
Mg + Fe(NO3)2 → Mg(NO3)2 + Fe
Mg + CuSO4 → MgSO4 + Cu
Câu 2:
23/07/2024Dãy gồm các kim loại phản ứng được với H2SO4 loãng là
 Xem đáp án
Xem đáp án
Đáp án B
Loại A, C và D do đồng (Cu) không phản ứng với H2SO4 loãng.
Câu 3:
21/07/2024Dãy kim loại phản ứng được với nước ở nhiệt độ thường
 Xem đáp án
Xem đáp án
Đáp án B
Kim loại kiềm phản ứng với nước ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
2Li + 2H2O → 2LiOH + H2
Câu 4:
18/11/2024Tính chất hóa học chung của kim loại gồm
 Xem đáp án
Xem đáp án
Đáp án đúng là : C
- Tính chất hóa học chung của kim loại gồm Tác dụng với phi kim, tác dụng với axit, tác dụng với dung dịch muối.
+ Tác dụng với phi kim
Kim loại phản ứng vói phi kim tạo thành hợp chất ion hoặc cộng hóa trị,thường là oxit muối,hoặc sulfua.
+ Tác dụng với axit
Kim loại phản ứng với axit giải phóng khí hydro và tạo muối (đối với axit không có tính oxi hóa mạnh).
+ Tác dụng với dung dịch muối
Kim loại mạnh hơn (đứng trước trong dãy hoạt động hóa học) có thể đẩy kim loại yếu hơn ra khỏi dung dịch muối của nó.
→ C đúng.A,B,D sai.
* Kim loại có những tính chất hóa học sau:
1. Tác dụng với phi kim
a) Tác dụng với oxi:
Hầu hết kim loại (trừ Au, Pt, Ag,..) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
Ví dụ:
2Cu + O2 2CuO
3Fe + 2O2 Fe3O4
b) Tác dụng với phi kim khác (Cl2, S,...):
Nhiều kim loại tác dụng với nhiều phi kim, tạo thành muối.
Ví dụ:
Fe + S FeS
Cu + Cl2 CuCl2
2Na + Cl2 2NaCl
2. Tác dụng với dung dịch axit
Nhiều kim loại tác dụng với dung dịch axit (HCl, H2SO4 loãng...) tạo thành muối và H2.
Ví dụ:
Fe + 2HCl → FeCl2 + H2 ↑
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2 ↑
Mg + 2HCl → MgCl2 + H2 ↑
3. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn (trừ các kim loại phản ứng với nước như Na, K, Ba, Ca...) tác dụng với muối của kim loại yếu hơn, tạo thành muối mới và kim loại mới.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Mg + FeCl2 → MgCl2 + Fe↓
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa 9 Bài 16: Tính chất hóa học của kim loại
Mục lục Giải SBT Hóa 9 Bài 15, 16 và 17: Tính chất của kim loại và dãy hoạt động của kim loại
Câu 5:
21/07/2024Ngâm một viên Zn sạch trong dung dịch CuSO4. Hiện tượng quan sát được là
 Xem đáp án
Xem đáp án
Đáp án B
Kẽm (Zn) đứng trước đồng (Cu) trong dãy điện hóa do đó đẩy được đồng ra khỏi dung dịch muối.
+ Hiện tượng: Một phần viên kẽm bị hòa tan, có một lớp màu đỏ bám ngoài viên kẽm và màu xanh lam của dung dịch nhạt dần.
+ Phương trình hóa học:
Zn + CuSO4 → Cu + ZnSO4
Câu 6:
23/07/2024Kim loại M có hóa trị II. Cho 8,4 gam M tác dụng hết với dung dịch HCl sinh ra 7,84 lít khí hiđro (đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án C
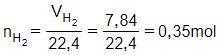
Phương trình hóa học:
M + 2HCl →MCl2 + H2
Theo phương trình:
nM1=nH21=0,35→nM=0,35mol→MM=mMnM=8,40,35=24(g/mol)
Kim loại M là Magie (Mg).
Câu 7:
23/07/2024Cho 4,6 gam natri tác dụng hoàn toàn với 35,6 gam nước. Nồng độ phần trăm của dung dịch tạo thành là
 Xem đáp án
Xem đáp án
Đáp án C
nNa=mNaMNa=4,623=0,2mol
Phương trình hóa học:
2Na + 2H2O→2NaOH + H2
Theo phương trình:
nNaOH2=nNa2=0,22=0,1
→nNaOH = 0,1.2 = 0,2 mol
Khối lượng NaOH tạo thành là:
mNaOH = nNaOH MNaOH
= 0,2 40 = 8 gam
Khối lượng dung dịch thu được là:
m(dung dịch) = mNa+mH2O−mH2
m(dung dịch) = 4,6 + 35,6 - nH2.MH2
m(dung dịch) = 4,6 + 35,6 – 0,1.2
m(dung dịch) = 40 gam
Nồng độ phần trăm dung dịch NaOH tạo thành là
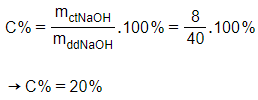
Câu 8:
23/07/2024Ngâm một đinh sắt (Fe) trong 10 mL dung dịch CuSO4 1M. Khối lượng đồng (Cu) thu được sau phản ứng là
 Xem đáp án
Xem đáp án
Đáp án A
nCuSO4=CM(CuSO4).VCuSO4nCuSO4=1.0,01=0,01mol
Phương trình hóa học:
Fe + CuSO4 →Cu + FeSO4
Theo phương trình:
nCu1=nCuSO41=0,011=0,01→nCu=0,01 mol
mCu = nCu MCu = 0,01.64 = 0,64 gam
Câu 9:
15/07/2024Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là
 Xem đáp án
Xem đáp án
Đáp án C
Giả sử kim loại A có hóa trị n (n = 1, 2, 3, 4)
→Công thức oxit của kim loại A là A2On.
Trong hợp chất oxit của kim loại A, oxi chiếm 17,02% theo khối lượng.
Ta có bảng sau:
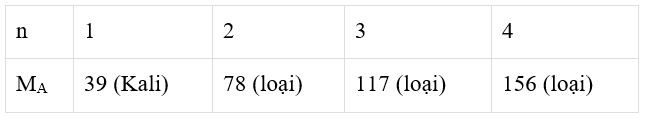
Vậy A là Kali
Câu 10:
20/07/2024Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi công thức của oxit là A2O3
Phương trình hóa học:
A2O3 + 6HCl → 2ACl3 + 3H2O
Theo phương trình:
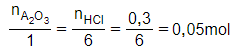
MA2O3= 2.MA + 3.16
⇒MA2O3= 2MA + 48 = 102
→MA = 27 →A là nhôm.
Vậy oxit là Al2O3.
Câu 11:
21/07/2024Hòa tan hoàn toàn 18 gam một kim loại M (biết hóa trị của kim loại trong khoảng từ I đến III) cần dùng 800 mL dung dịch HCl 2,5M. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án C
nHCl=0,8.2,5=2mol
Gọi kim loại M có hóa trị n (n = 1,2,3)
Phương trình hóa học:
2M+2nHCl→2MCln+nH2
Theo phương trình:
nM2=nHCl2n=22n=1n→nM=2nMM=mMnM=182n=9n
Ta có bảng sau:

Vậy kim loại M là Al.
Câu 12:
22/07/2024Cho 6,5 gam Zn vào dung dịch HCl dư. Thể tích khí thu được từ phản ứng ở đktc là
 Xem đáp án
Xem đáp án
Đáp án B
nZn=mZn65=0,1mol
Phương trình hóa học:
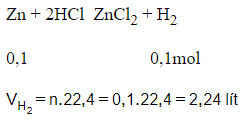
Câu 13:
23/07/2024Cho lá nhôm (Al) vào dung dịch axit HCl dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án B
nH2=VH222,4=3,3622,4=0,15mol
Phương trình hóa học:
2Al + 6HCl(dư) 2AlCl3 + 3H2
nAl2=nH23=0,153→nAl=0,1mol→mAl=nAl.MAl=0,1.27=2,7gam
Câu 14:
21/07/2024Cho phản ứng hóa học:
x… + H2SO4 → FeSO4 + y…↑.
Tổng (x + y) có thể là
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
Fe + H2SO4 → FeSO4 + H2↑
→Tổng (x + y) = 1+1 = 2
Câu 15:
21/07/2024Cho phản ứng:
Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O.
Tỉ lệ x, y là
 Xem đáp án
Xem đáp án
Đáp án A
- Phương trình hóa học:
Fe3O4 + 8HCl →xFeCl2 + yFeCl3 + 4H2O
- Số nguyên tử Fe bên trái bằng số nguyên tử Fe bên phải
→3=x+y(1)
Số nguyên tử Cl bên trái bằng số nguyên tử Cl bên phải
→8 = 2x + 3y (2)
Từ (1) và (2) suy ra: x = 1; y = 2.
Vậy x : y = 1 : 2.
