Giải bài tập trang 5, 7 Chuyên đề Hóa 10 Bài 1 - Kết nối tri thức
Với giải bài tập trang 5, 7 Chuyên đề Hóa 10 trong Bài 1: Liên kết hóa học sách Chuyên đề Hóa lớp 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Chuyên đề Hóa 10 trang 5, 7.
Giải bài tập trang 5, 7 Chuyên đề Hóa 10 - Kết nối tri thức
Câu hỏi mở đầu trang 5 Chuyên đề Hóa 10: Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực, … của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử?
Lời giải:
Để dự đoán dạng hình học của một phân tử ta có thể dựa vào mô hình VSEPR.
B/ Câu hỏi giữa bài
I. Công thức Lewis
Câu hỏi 1 trang 7 Chuyên đề Hóa 10: Công thức Lewis của CS2 là
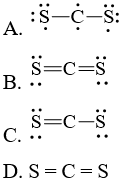
Lời giải:
Đáp án đúng là: B
Tổng số electron hóa trị = 1.4 + 2.6 = 16 electron.
Trong phân tử CS2, nguyên tử C cần 4 electron để đạt octet, nguyên tử S cần 2 electron hóa trị để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử S được xếp quanh: S – C – S.
Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet: 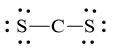
Số electron hóa trị còn lại = 16 – 2.2 – 2.6 = 0
Số electron hóa trị của nguyên tử C là 4 nên đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử C.
Công thức Lewis của CS2 là ![]()
Câu hỏi 2 trang 7 Chuyên đề Hóa 10: Trình bày các bước để viết công thức Lewis của phân tử NH3.
Lời giải:
Bước 1. Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2. Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
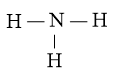
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.
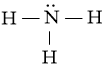
Câu hỏi 3 trang 7 Chuyên đề Hóa 10: Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Lời giải:
a) Công thức Lewis của Cl2 là:
Bước 1. Số electron hóa trị là 2.7 = 14 electron
Bước 2. Trong phân tử Cl2, mỗi nguyên tử Cl cần 1 electron để đạt octet.
Cl – Cl
Bước 3. Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet:
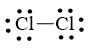
Bước 4. Số electron hóa trị còn lại là: 14 – 6.2 – 2.1 = 0
Cả hai nguyên tử Cl đều đạt octet nên công thức Lewis của Cl2 là: ![]()
Công thức Lewis của N2 là:
Bước 1. Số electron hóa trị là 5.2 = 10 electron
Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
N – N
Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet: ![]()
Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
![]()
b) Công thức Lewis của SO2 là:
Số electron hóa trị là 1.6 + 2.6 = 18 electron.
Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh: O – S – O.
Hoàn thiện octet cho nguyên tử O: ![]()
Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
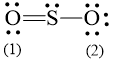
Công thức Lewis của SO3 là:
- Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
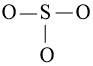
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
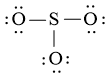
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
chung.
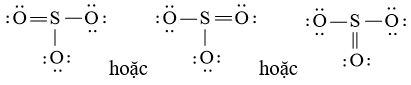
c) Công thức Lewis của H2O là:
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh. H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
![]()
Công thức Lewis của H2S là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh: H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
![]()
Công thức Lewis của HOCl là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quang: H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 7 electron hóa trị để đạt octet:
![]()
Bước 4: Số electron hóa trị còn lại: 14 – 2.2 – 1.6 = 4
Số electron hóa trị của O là 4, nên chuyển 4 electron còn lại vào nguyên tử O.
Công thức Lewis của HOCl là
![]()
Câu hỏi 4 trang 7 Chuyên đề Hóa 10: Công thức Lewis biểu diễn cấu tạo của NO2 là
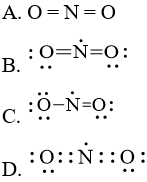
Lời giải:
Đáp án đúng là: C
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh: O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
![]()
Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là
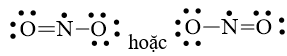
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
