Giải bài tập trang 12 Chuyên đề Hóa 10 Bài 1 - Kết nối tri thức
Với giải bài tập trang 12 Chuyên đề Hóa 10 trong Bài 1: Liên kết hóa học sách Chuyên đề Hóa lớp 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Chuyên đề Hóa 10 trang 12.
Giải bài tập trang 12 Chuyên đề Hóa 10 - Kết nối tri thức
Câu hỏi 10 trang 12 Chuyên đề Hóa 10: Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hóa nào?
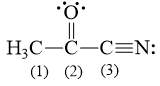
Lời giải:
C (1) lai hóa sp3 bởi vì C này chỉ tạo liên kết đơn.
C (2) lai hóa sp2 bởi vì C này có tạo liên kết đôi.
C (3) lai hóa sp bởi vì C này có tạo liên kết ba.
Câu hỏi 11 trang 12 Chuyên đề Hóa 10: Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2. b) Phân tử SO2. c) Phân tử NH3.
Lời giải:
a) Phân tử BeH2.
Cấu hình electron hóa trị của Be: 2s2.
Trong nguyên tử Be, một AO 2s tổ hợp với 1 AO 2p, tạo ra hai AO lai hóa sp.
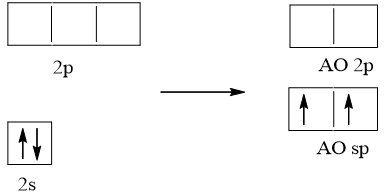
Hai AO lai hóa sp của nguyên tử Be xen phủ với hai AO s của hai nguyên tử H tạo thành hai liên kết σ giữa Be – H. Nguyên tử trung tâm Be không còn electron chưa liên kết nên hai AO lai hóa đẩy nhau với lực lớn nhất tạo góc 180o. Trong phân tử BeH2, nguyên tử Be còn hai AO – p không lai hóa và là AO trống.
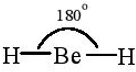
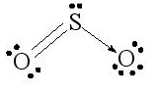
b) Phân tử SO2.
Cấu hình electron hóa trị của S: 3s23p4.
Trong nguyên tử S, một AO 3s lai hóa với hai AO p, tạo ra ba AO lai hóa sp2.
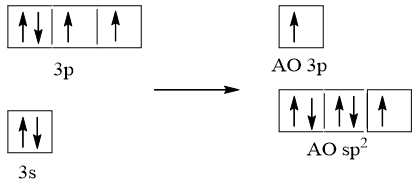
Nguyên tử S dùng AO lai hóa sp2 thứ nhất (chứa 1 e độc thân) xen phủ với AO p của một trong hai nguyên tử O tạo liên kết σ và dùng AO không lai hóa chứa 1 e độc thân xen phủ với AO p của chính nguyên tử O đó tạo ra liên kết π. Nguyên tử S dùng AO lai hóa sp2 thứ hai chứa cặp e tạo liên kết cho – nhận với AO trống của nguyên tử O còn lại và nguyên tử S còn AO lai hóa sp2 thứ ba chứa cặp e không liên kết. Do cặp e không liên kết đẩy mạnh hơn hai cặp e liên kết nên phân tử SO2 có dạng góc (chữ V)
c) Phân tử NH3.
Công thức Lewis của NH3 là:
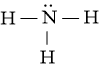
⇒ Công thức VSEPR của NH3 là: AX3E1
Từ công thức VSEPR dự đoán được trạng thái lai hóa của nguyên tử N trong phân tử NH3 là sp3.
Cấu hình electron của N là: 1s22s22p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
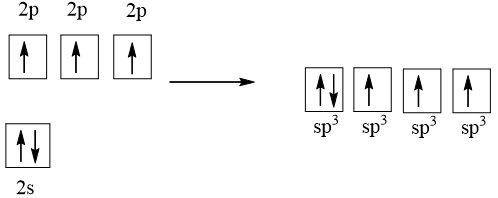
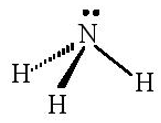
Ba AO lai hóa sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 1s của 3 nguyên tử H, tạo va liên kết σ, hướng về ba đỉnh của hình tứ diện. Nguyên tử N còn 1 AO lai hóa sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của tứ diện. Tuy nhiên cặp electron chưa liên kết này đẩy mạnh hơn nên làm góc liên kết giảm, nên nhỏ hơn 109,5o
Câu hỏi 12 trang 12 Chuyên đề Hóa 10: Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Lời giải:
a) Trong phân tử NCl3, nguyên tử N là nguyên tử trung tâm lai hóa sp3.
Trong phân tử SO3, nguyên tử S là nguyên tử trung tâm, lai hóa sp2.
Trong phân tử CO2, nguyên tử C là nguyên tử trung tâm, lai hóa sp.
b) Phân tử NCl3, SO3 phân cực vì liên kết giữa nguyên tử trung tâm với nguyên tử còn lại là liên kết phân cực.
Phân tử CO2 không phân cực vì hai liên kết phân cực C = O bị triệt tiêu do phân tử có dạng đường thẳng.
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
