Giải SBT Hóa 11 CTST Bài 2: Cân bằng trong dung dịch nước
Giải SBT Hóa 11 CTST Bài 2: Cân bằng trong dung dịch nước
-
82 lượt thi
-
23 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
21/07/2024Vì sao dung dịch của các muối, acid, base dẫn điện?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các muối, acid, base dẫn điện do muối, acid, base có khả năng phân li ra ion trong dung dịch.
Ví dụ: NaCl → Na+ + Cl-
Câu 2:
12/07/2024Dung dịch sodium chloride (NaCl) dẫn được điện là do
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dung dịch sodium chloride (NaCl) dẫn được điện là do NaCl điện li trong nước thành ion.
Phương trình điện li: NaCl → Na+ + Cl-
Câu 3:
20/07/2024Saccharose là chất không điện li vì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Saccharose là chất không điện li vì phân tử saccharose không có khả năng phân li thành ion trong nước.
Câu 4:
22/07/2024Phát biểu nào sau đây đúng khi nói về sự điện li?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Sự điện li là quá trình phân li một chất trong nước thành ion.
Câu 5:
11/07/2024Các chất trong dãy nào sau đây là những chất điện li mạnh?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Chất điện li mạnh là HCl, NaOH, NaCl vì HCl là acid mạnh, NaOH là base mạnh và NaCl là muối tan.
HCl → H+ + Cl-
NaOH → Na+ + Cl-
NaCl → Na+ + Cl-
Câu 6:
13/07/2024Phương trình điện li nào sau đây biểu diễn không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
HF là acid yếu nên điện li không hoàn toàn.
HF H+ + F-
Câu 7:
20/07/2024Phương trình điện li nào sau đây biểu diễn đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
NaOH là base mạnh; Al2(SO4)3, NH4Cl là muối nên điện li hoàn toàn, biểu diễn bằng mũi tên 1 chiều (→).
HClO là acid yếu nên điện li một phần, biểu diễn bằng hai nửa mũi tên ngược chiều nhau ( ).
Câu 8:
18/07/2024Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) ... vào dung dịch đựng trong bình tam giác. Dụng cụ cần điền vào (1) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác.
Câu 9:
11/07/2024Cho các chất sau: glucose (C6H12O6), NaCl, KOH, Ba(OH)2, AlCl3, CuSO4, N2, O2, H2SO4, saccharose (C12H22O11)
Chất nào là chất điện li trong các chất trên?
 Xem đáp án
Xem đáp án
Chất điện li là NaCl, KOH, Ba(OH)2, AlCl3, CuSO4, H2SO4
NaCl → Na+ + Cl-
KOH → K+ + OH-
Ba(OH)2 → Ba2+ + 2OH-
AlCl3 → Al3+ + 3Cl-
CuSO4 → Cu2+ + SO42-
H2SO4 → 2H+ + SO42-
Câu 10:
17/07/2024Viết phương trình điện li của các chất sau trong nước: HBr, HNO3, KOH, Ca(OH)2, Al2(SO4)3, Cu(NO3)2, NaI, HCN, HF, HCOOH.
 Xem đáp án
Xem đáp án
HBr → H+ + Br-
HNO3 → H+ + NO3-
KOH → K+ + OH-
Ca(OH)2 → Ca2+ + 2OH-
Al2(SO4)3 → 2Al3+ + 3SO42-
Cu(NO3)2 → Cu2+ + 2NO3-
NaI → Na+ + I-
HCN H+ + CN-
HF H+ + F-
HCOOH H+ + HCO O-
Câu 11:
22/07/2024Tính nồng độ mol của các ion trong các dung dịch sau:
a) Ba(NO3)2 0,1 M. b) HNO3 0,02 M. c) KOH 0,01 M.
 Xem đáp án
Xem đáp án
a) Ba(NO3)2 → Ba2+ + 2NO3‑
0,1 0,1 0,2 (M)
b) HNO3 → H+ + NO3-
0,02 0,02 0,02 (M)
c) KOH → K+ + OH-
0,01 0,01 0,01 (M)
Câu 12:
20/07/2024Khả năng dẫn điện của nước vôi trong (dung dịch Ca(OH)2 trong nước) để trong không khí giảm dần theo thời gian. Hãy giải thích điều này.
 Xem đáp án
Xem đáp án
Nước vôi trong hấp thụ CO2 trong không khí tạo thành CaCO3 và H2O, làm giảm nồng độ của Ca(OH)2 nên khả năng dẫn điện giảm.
Câu 13:
23/07/2024Trong các phản ứng dưới đây, hãy cho biết ở phản ứng nào nước đóng vai trò là acid, ở phản ứng nào nước đóng vai trò là base theo thuyết Bronsted - Lowry:
a) HCl + H2O → H3O+ + Cl-
b) NH3 + H2O NH4+ + OH-
c) CH3COOH + H2O H3O+ + CH3COO-
d) CO3- + H2O HCO3- + OH-
 Xem đáp án
Xem đáp án
Theo thuyết Bronsted – Lowry, chất nhận H+ đóng vai trò là base, chất cho H+ đóng vai trò là acid.
Nước đóng vai trò acid: b, d.
Nước đóng vai trò base: a, c.
Câu 14:
20/07/2024Cho các phân tử và ion sau: HI, CH3COO-, H2PO4-, PO3-, NH3, S2-, HPO2-. Hãy cho biết phân tử, ion nào là acid, base, lưỡng tính theo thuyết Bronsted - Lowry. Giải thích.
 Xem đáp án
Xem đáp án
Acid: HI
Giải thích: HI + H2O → H3O+ + I-
Base: CH3COO-, S2- , PO43-, NH3
CH3COO- + H2O CH3COOH + OH-
S2- + H2O OH- + HS-
PO43- + H2O H2PO4- + OH-
NH3 + H2O NH4+ + OH-
Lưỡng tính: HPO42-, H2PO4-
HPO42- + H2O OH- + H2PO4-
HPO42- + H2O H3O+ + PO43-
H2PO4- + H2O OH- + H3PO4
H2PO4- + H2O H3O+ + HPO42-
Câu 15:
23/07/2024a) Tính pH của dung dịch có nồng độ ion H+ là 4,2.10-10 M.
 Xem đáp án
Xem đáp án
a) pH = - lg(4,2.10-10) = 9,38.
Câu 16:
20/07/2024 Xem đáp án
Xem đáp án
b) [H+] = 10-6,35 = 4,5.10-7.
Câu 17:
20/07/2024c) Tính pH của dung dịch có nồng độ ion OH- là 4,0.10-11 M. .
 Xem đáp án
Xem đáp án
c) pH = 14 + log[OH-] pH = 14 – 10,4 = 3,6.
Câu 18:
22/07/2024Cho 10 mL dung dịch HCl có pH = 3. Hãy đề nghị cách pha dung dịch có pH = 4 từ dung dịch trên.
 Xem đáp án
Xem đáp án
Gọi x (L) là thể tích nước cần cho vào dung dịch để thực hiện việc pha chế.
pH = 3 [H+] = 0,001 (M) nH+ = nHCl = 0,01.0,001 = 10-5 (mol).
pH = 4 [H+] = 0,0001 (M) = x = 0,09 (L) = 90 (mL).
Cách pha: Đong 90 mL nước cất cho từ từ vào bình đựng 10 mL dung dịch HCl có pH = 3. Dùng đũa thuỷ tinh khuấy đều.
Câu 19:
22/07/2024Vì sao người ta không sử dụng dung dịch acid HNO3 trong phương pháp chuẩn độ acid - base?
 Xem đáp án
Xem đáp án
HNO3 không bền, khi có ánh sáng dễ bị phân huỷ nên không dùng trong chuẩn độ acid - base vì sẽ làm sai lệch kết quả phân tích.
Câu 20:
19/07/2024Trộn 3 dung dịch H2SO4 0,1 M, HNO3 0,2 M và HCl 0,3 M với thể tích bằng nhau thu được dung dịch (A). Lấy 300 mL dung dịch (A) cho tác dụng với một dung dịch (B) gồm NaOH 0,20 M và KOH 0,29 M. Tính thể tích dung dịch (B) cần dùng để sau khi tác dụng với 300 mL dung dịch (A) thu được dung dịch có pH = 2.
 Xem đáp án
Xem đáp án
nH+(trong 300mL dung dịch A) = 0,07 mol.
Gọi thể tích dung dịch (B) là VB (L) ta có: nOH-= 0,2VB + 0,29VB = 0,49VB
Khi trộn (A) với (B) ta có: H+ + OH- → H2O
Dung dịch sau khi trộn có pH = 2 [H+] = 10-2 (M).
[H+](dư) = .
Câu 21:
22/07/2024Để chuẩn độ 40 mL dung dịch HCl chưa biết nồng độ đã dùng trung bình hết 34 mL dung dịch NaOH 0,12 M. Tính nồng độ mol của dung dịch HCl.
 Xem đáp án
Xem đáp án
Phản ứng chuẩn độ:
HCl + NaOH → NaCl + H2O
Câu 22:
11/07/2024Để chuẩn độ 50 mL dung dịch CH3COOH chưa biết nồng độ đã dùng trung bình hết 75 mL dung dịch NaOH 0,05 M. Tính nồng độ mol của dung dịch CH3COOH.
 Xem đáp án
Xem đáp án
nNaOH = 0,075.0,05 = 0,00375 (mol).
CH3COOH + NaOH → CH3COONa + H2O
0,00375 0,0375 (mol)
Câu 23:
23/07/2024Trong phương pháp chuẩn độ acid - base, xung quanh điểm tương đương có một sự thay đổi pH đột ngột gọi là bước nhảy chuẩn độ. Đường biểu diễn trên đồ thị chuẩn độ acid - base gọi là đường định phân.
Từ các số liệu sau đây, hãy vẽ đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH 0,100 M. Trục hoành ghi thể tích dung dịch NaOH, trục tung ghi pH của dung dịch. Xác định giá trị điểm tương đương và khoảng bước nhảy chuẩn độ của quá trình này.
|
VNaOH (mL) |
Giá trị pH |
VNaOH (mL) |
Giá trị pH |
|
0,0 |
1,00 |
25,1 |
10,30 |
|
5,0 |
1,18 |
25,5 |
11,00 |
|
10,0 |
1,37 |
260 |
11,29 |
|
15,0 |
1,60 |
28,0 |
11,75 |
|
200 |
1,95 |
30,0 |
11,96 |
|
22,0 |
2,20 |
35,0 |
12,22 |
|
240 |
2 69 |
40,0 |
12,36 |
|
24,5 |
300 |
45,0 |
12,46 |
|
24,9 |
3,70 ỉ |
50,0 |
12,52 |
|
25,0 |
7,00 |
|
|
 Xem đáp án
Xem đáp án
- Đồ thị quá trình chuẩn độ dung dịch HCI bằng dung dịch chuẩn NaOH
0,100 M được trình bày như hình:
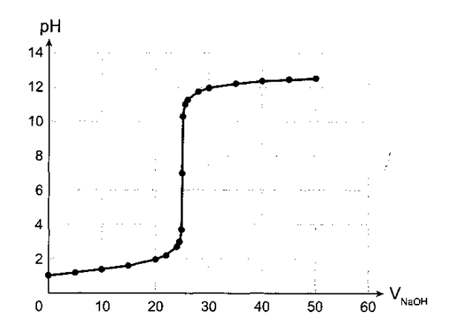
- Điểm tương đương ở pH = 7.
- Bước nhảy chuẩn độ ở khoảng pH từ 3,7 đến 10,3.
