Đề thi học kì 1 Hóa học 9 có đáp án ( đề 9 )
-
1735 lượt thi
-
19 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Cho các oxit sau: P2O5, Na2O, CO2, ZnO, MgO, CuO, Al2O3, BaO, FeO, SO3. Trong các oxit trên, số oxit tác dụng được với nước là a, số oxit tác dụng được với dung dịch H2SO4 loãng là b, số oxit tác dụng được với dung dịch bazơ là c. Giá trị a, b, c lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Oxit tác dụng được với nước: P2O5, Na2O, CO2, BaO, SO2
- Oxit tác dụng được với dung dịch H2SO4 loãng: Na2O, ZnO, MgO, CuO, Al2O3, BaO, FeO
- Oxit tác dụng được với dung dịch Bazơ là: P2O5, CO2, ZnO, Al2O3, SO2
Câu 2:
23/07/2024Cho các muối A, B, C, D không theo thứ tự là các muối CaCO3, CaSO4, Pb(NO3)2, NaCl.
- A không được phép có trong thức ăn vì tính độc của nó.
- B là thành phần chính trong nước biển.
- C là muối không tan trong nước, bị phân hủy ở nhiệt độ cao.
- D là thành phần chính của thạch cao.
A, B, C, D lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 4:
23/07/2024Chất nào sau đây không dùng để làm khô khí CO2?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
CO2 có thể tác dụng với dung dịch NaOH nên NaOH rắn không được dùng để làm khô khí CO2
Câu 5:
23/07/2024Cho dãy gồm các dung dịch MgCl2, NaOH, H2SO4, CuSO4, Fe(NO3)3. Khi cho các dung dịch trên tác dụng với nhau từng đôi một thì số phản ứng không xảy ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Câu 6:
23/07/2024Cho các phát biểu sau:
(1) Gang là hợp kim của sắt chứa từ 1 – 3,1% các nguyên tố C, Si, Mn, S; còn lại là Fe
(2) Théo là hợp kim của sắt, trong đó hàm lượng cacbon chiếm từ 0,01 – 2%
(3) Théo được sử dụng trong ngành chế tạo máy và máy bay
(4) Để luyện thép, người ta oxi hóa gang nóng chảy để loại phần lớn các nguyên tố C, P, Si, Mn, S
(5) Théo đặc biệt là thép ngoài những nguyên tố có sẵn như thép thường còn có thêm các nguyên tố khác là Cr, Ni, W, Mn,…
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu đúng là (2), (3), (4), (5)
Câu 7:
23/07/2024Chất nào sau đây có thể dùng làm thuốc thử phân biệt hai dung dịch HCl và H2SO4.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
BaCl2 tạo kết tủa trắng với H2SO4 và không tác dụng với HCl
Câu 8:
23/07/2024Dãy kim loại nào đều phản ứng trực tiếp với dung dịch CuSO4?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các kim loại đứng trước Cu trong dãy hoạt động hóa học của kim loại (trừ Li, K, Na, Ca, Ba) có thể đẩy Cu ra khỏi dung dịch muối của nó.
Câu 9:
23/07/2024Cho 12,8g kim loại M phản ứng vừa đủ với 4,48 lít khí Cl2 (đktc) tạo muối clorua có công thức là MCl2. Xác định kim loại M?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số mol khí clo phản ứng là:
Từ phương trình
Vậy kim loại M là Cu
Câu 10:
23/07/2024Cho các phương trình hóa học sau:
Số phương trình hóa học sai là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình (1) và (4) không xảy ra vì Cu hoạt động hóa học yếu hơn Fe, Ag hoạt động hóa học yếu hơn Cu.
Câu 11:
23/07/2024Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro.
Ví dụ để so sánh mức độ hoạt động của flo và clo, ta xét khả năng phản ứng của 2 phi kim đó với khí hiđro:
Phản ứng trên xảy ra ngay trong bóng tối ở nhiệt độ thấp, tạo ra hỗn hợp nổ mạnh.
Phản ứng trên cần điều kiện ánh sáng và nhiệt độ để xảy ra
Do đó kết luận F2 hoạt động mạnh hơn Cl2
Câu 12:
23/07/2024Cho 13g hỗn hợp bột sắt và đồng tác dụng với lượng dư dung dịch H2SO4, thu được 4,48 lít khí hiđro ở đktc. Khối lượng đồng có trong hỗn hợp là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chỉ có sắt tác dụng với axit sunfuric giải phóng khí hiđro
Số mol H2 là:
Từ phương trình
Khối lượng của đồng trong hỗn hợp ban đầu là:
mCu = mhh – mFe = 13 – 11,2 = 1,8 (g)
Câu 13:
23/07/2024Phản ứng nào sau đây không xảy ra?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các muối sunfua như CuS, PbS, Ag2S…không tan trong nước lẫn axit nên phương trình của đáp án B không xảy ra.
Câu 14:
23/07/2024Dãy gồm tất cả các chất khí tác dụng với dung dịch H2SO4 đặc, nóng không tạo ra khí SO2 là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 15:
23/07/2024Cho thí nghiệm như hình sau:
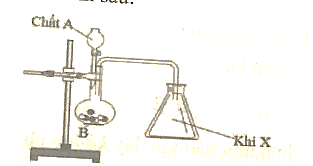
Chất B và X tương ứng trong thí nghiệm là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Từ hình vẽ ta thấy có thể thu X bằng cách đẩy không khí và bình thu đặt đứng nên X là khí nặng hơn không khí và được điều chế từ chất rắn B và dung dịch A.
Vì vậy chất rắn B là MnO2 và khí X là Cl2
Phương trình phản ứng xảy ra:
Câu 17:
23/07/2024Sử dụng thêm một kim loại, hãy phân biệt các dung dịch chứa trong các lọ mất nhãn sau: HCl, K2CO3, BaCl2, Na2SO4
 Xem đáp án
Xem đáp án
Phân biệt như bảng dưới đây:
|
|
HCl |
K2CO3 |
BaCl2 |
Na2SO4 |
|
Kim loại Fe |
Khí thoát ra |
Không hiện tượng |
Không hiện tượng |
Không hiện tượng |
|
HCl |
|
Khí thoát ra |
Không hiện tượng |
Không hiện tượng |
|
K2CO3 |
|
|
Kết tủa trắng |
Không hiện tượng |
Các phương trình hóa học xảy ra:
Câu 18:
23/07/2024Khi nhỏ dung dịch H2SO4 đặc vào đường trắng C12H22O11 thì thấy đường chuyển dần sang màu đen và có khí sủi bọt, hiện tượng này là do tính chất nào của axit sunfuric đặc? Viết phương trình minh họa.
 Xem đáp án
Xem đáp án
Khi nhỏ H2SO4 đặc vào được C12H22O11 đường màu trắng chuyển dần sang màu đen, xốp, đẩy lên khỏi miệng cốc, phản ứng tỏa rất nhiều nhiệt. Chất rắn màu đen là cacbon, do H2SO4 đặc có tính háo nước mạnh đã loại đi hai nguyên tố có trong thành phần của nước là H và O ra khỏi đường.
Sau đó, một phần C sinh ra lại bị H2SO4 đặc oxi hóa tạo thành các chất khí CO2 và SO2 gây sủi bọt trong cốc làm C dâng lên.
Câu 19:
23/07/2024Cho 4 gam hỗn hợp X gồm magie và mafie oxit tác dụng vừa đủ với m gam dung dịch H2SO4 14,6% thu được 2,24 lít khí (đktc)
a) Tính thành phần phần trăm theo khối lượng từng chất trong hỗn hợp X
b) Tính giá trị của m
 Xem đáp án
Xem đáp án
a) Số mol H2 thoát ra là:
Từ phương trình (1)
Thành phần phần trăm theo khối lượng các chất trong X là:
b) Từ phương trình (1)
Khối lượng MgO là:
Từ phương trình (2)
Số mol H2SO4 đã phản ứng là:
Khối lượng chất tan H2SO4 là:
Khối lượng dung dịch H2SO4 đã dùng là:
Bài thi liên quan
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 1 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 2 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 3 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 4 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 5 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 6 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 7 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 8 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 10 )
-
19 câu hỏi
-
45 phút
-
