Đề thi học kì 1 Hóa học 9 có đáp án ( đề 8 )
-
1737 lượt thi
-
19 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Khí nào sau đây không thể được làm khô bằng CaO?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khí CO2 không thể được làm khô bằng CaO vì khi có mặt hơi nước, CaO sẽ tác dụng với nước tạo thành Ca(OH)2, Ca(OH)2 tác dụng với CO2 nên không thể thu lại khí CO2.
Câu 2:
23/07/2024Chất nào sau đây tác dụng với dung dịch HCl tạo thành dung dịch màu vàng nâu?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dung dịch FeCl3 là dung dịch màu vàng nâu.
Câu 3:
23/07/2024Dãy oxit nào sau đây đều tác dụng với dung dịch bazơ tạo muối và nước?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các oxit tác dụng với dung dịch bazơ tạo muối và nước là oxit axit
Câu 4:
23/07/2024Để thu được khí oxi từ hỗn hợp khí oxi, sunfurơ và cacbonic, người ta cho hỗn hợp đi qua dung dịch chứa:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi cho hỗn hợp khí đi qua dung dịch Ca(OH)2, Ca(OH)2 tác dụng với CO2 và SO2 mà không tác dụng với O2 nên ta thu được khí oxi không lẫn tạp chất.
Câu 5:
23/07/2024Cho các phân bón: (NH4)HPO4, NH4NO3, K2CO3, CaHPO4. Số phân bón đơn là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phân bón đơn là phân bón chỉ chứa một trong ba nguyên tố dinh dưỡng chính là đạm (N), lân (P), kali (K): NH4NO3, K2CO3, CaHPO4
Câu 6:
23/07/2024Phản ứng nào sau đây được sử dụng để điều chế natri hiđroxit trong công nghiệp?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong công nghiệp, natri hiđroxit được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa:
Câu 8:
23/07/2024Phản ứng nào dưới đây không xảy ra?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khó CO chỉ khử được các oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học, do đó CO không thể khử MgO thành Mg.
Câu 9:
23/07/2024Quá trình nào sau đây không làm giảm lượng khí oxi trong không khí?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Quang hợp là quá trình trong đó cây xanh sử dụng nước, khí cacbonic và ánh sáng mặt trời để tổng hợp nên chất hữu cơ, giải phóng khí oxi. Do đó quang hợp làm tăng lượng oxi trong không khí đồng thời giảm lượng khí cacbonat. Vì vậy muốn giữ môi trường trong lành, chính ta cần phải trồng thật nhiều cây xanh.
Câu 10:
23/07/2024Khối lượng oxi cần dùng để đốt cháy vừa đủ hỗn hợp gồm 6g than và 8g lưu huỳnh là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số mol cacbon và lưu huỳnh là:
Từ phương trình, số mol khí oxi cần dùng là:
Khối lượng oxi cần dùng là:
Câu 11:
23/07/2024Dãy so sánh đúng tính phi kim của các nguyên tố là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong cùng một chu kì, đi từ trái sang phải theo chiều điện tích hạt nhân tăng dần thì tính phi kim tăng dần.
Câu 12:
23/07/2024Sục từ từ 2,24 lít khí SO2 (đktc) vào 100ml dung dịch NaOH 3M. Dung dịch sau phản ứng gồm các chất nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol SO2 là:
100ml = 0,1 lít
Số mol NaOH là:
Lập tỉ lệ
Vậy sau phản ứng thu được muối Na2SO3 và NaOH dư
Câu 13:
23/07/2024Để bình đựng H2SO4 đặc trong không khí ẩm một thời gian thì khối lượng bình
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì H2SO4 đặc có tính háo nước mawnhj nên nếu để trong không khí ẩm, H2SO4 sẽ hút hơi nước trong không khí, làm tăng khối lượng của dung dịch.
Câu 14:
23/07/2024Hòa tan sắt (II) sunfua vào dung dịch HCl thu được khí X, đốt chát hoàn toàn khí X thu được khí Z có mùi hắc. Khí X và Z lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 15:
23/07/2024Bố trí một thí nghiệm điều chế khí trong phòng thí nghiệm như hình vẽ:
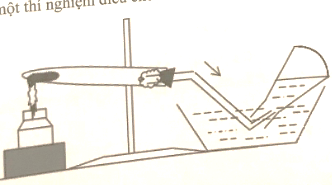
Chất khí đang điều chế có thể là chất nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hình vẽ cho thấy khí thu được bằng phương pháp đẩy nước (dời chỗ nước) chỉ áp dụng để thu những khí không tan hoặc ít tan trong nước, hoặc không tác dụng với nước. Vì vậy thí nghiệm trong hình có thể dùng để thu khí oxi.
Câu 17:
23/07/2024Từ sắt, lưu huỳnh, oxi và nước, hãy viết phương trình điều chế 1 oxit, 1 axit và 1 muối.
 Xem đáp án
Xem đáp án
- Điều chế oxit:
(oxit sắt từ)
hoặc
(lưu huỳnh đioxxit)
- Điều chế axit:
(axit sunfurơ)
hoặc
(axit sunfuric)
- Điều chế muối:
(sắt (II) sunfat)
hoặc
(sắt (III) sunfat)
Câu 18:
23/07/2024Tại sao khi tháo axit sunfuric đặc ra khỏi các toa thùng bằng thép, người ta phải khóa chốt ngay vòi lại thì toa thùng với không bị hư hỏng, còn đếu để mở thì sẽ không dùng được toa thùng nữa?
 Xem đáp án
Xem đáp án
Nếu sau khi tháo axit sunfuric đặc cứ để mở chốt vòi thì axit sunfuric đặc có tính háo nước mạnh sẽ hút hơi nước từ không khí, làm loãng axit còn lại trong thùng, axit loãng sẽ ăn mòn thép (thành phần chính là kim loại sát) dẫn đến hỏng thùng. Xảy ra hiện tượng như trên là do sắt thụ động hóa trong axit sunfuric đặc, nguội nhưng lại tác dụng với axit loãng. Vì vậy cần phải khóa chốt vòi lại ngay sau khi đã tháo axit.
PTHH:
Câu 19:
23/07/2024Hòa tan hoàn toàn hỗn hợp gồm Fe và FeS vào dung dịch HCl dư thu được 6,72 lít hỗn hợp khí (đktc). Dẫn hỗn hợp này qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen.
a) Viết các phương trình hóa học xảy ra.
b) Tính khối lượng các chất trong hỗn hợp ban đầu.
 Xem đáp án
Xem đáp án
a)
b)
Số mol kết tủa PbS là:
Từ phương trình
Số mol hỗn hợp khí là:
Vậy khối lượng Fe và FeS lần lượt là 5,6g và 17,6g
Bài thi liên quan
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 1 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 2 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 3 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 4 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 5 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 6 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 7 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 9 )
-
19 câu hỏi
-
45 phút
-
-
Đề thi học kì 1 Hóa học 9 có đáp án ( đề 10 )
-
19 câu hỏi
-
45 phút
-
