Đề kiểm tra Giữa học kì 2 Hóa 10 Cánh diều có đáp án
Đề kiểm tra Giữa học kì 2 Hóa 10 Cánh diều có đáp án - Đề 2
-
1087 lượt thi
-
32 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
16/07/2024Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
chọn đáp án A
Câu 5:
12/07/2024Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hoá -3 là
 Xem đáp án
Xem đáp án
chọn đáp án C
Câu 7:
14/07/2024Trường hợp nào sau đây không xảy ra phản ứng oxi hoá – khử?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 8:
21/07/2024Dẫn khí CO đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau: CuO + CO Cu + CO2. Trong phản ứng trên, chất đóng vai trò chất khử là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 9:
15/07/2024Cho các phản ứng hóa học sau:
(a) .
(b) .
(c) .
(d) .
Số phản ứng oxi hóa – khử là Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 10:
23/07/2024Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 11:
20/07/2024Trong giai đoạn đầu sản xuất nitric acid từ ammonia. Ammonia bị oxi hóa bởi oxygen ở nhiệt độ cao khi có chất xúc tác.
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
 Xem đáp án
Xem đáp án
Ta có:
Phương trình hóa học đã được cân bằng như sau:
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là: 4 + 5 + 4 + 6 = 19.
Câu 12:
21/07/2024Cho phản ứng sau:
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
 Xem đáp án
Xem đáp án
Ta có:
Phương trình đã được cân bằng như sau:
Tổng hệ số khi cân bằng các chất là 17.
Câu 13:
23/07/2024Dưới tác dụng của các chất xúc tác, glucose lên men tạo thành ethanol:
C6H12O6 2C2H5OH + 2CO2 (1)
Ethanol sinh ra lên men thành acetic acid:
C2H5OH + O2 CH3COOH + H2O (2)
Giả sử hiệu suất cả quá trình là 60%. Lượng glucose cần dùng để thu được 1 lít acetic acid 1M là
 Xem đáp án
Xem đáp án
Từ các phương trình hóa học (1) và (2)
Do hiệu suất cả quá trình là 60% nên:
Câu 14:
18/07/2024Cho 2,34 gam kim loại M (có hóa trị không đổi là n) tác dụng với dung dịch H2SO4 (đặc nóng, dư) thu được 3,2227 L SO2 (điều kiện chuẩn). Kim loại M là
 Xem đáp án
Xem đáp án
Ta có các quá trình:
Vậy n = 3, M = 27, kim loại M là Al thỏa mãn.
Câu 17:
17/07/2024Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 18:
12/07/2024Cho phản ứng sau:
H2(g) + Cl2(g) ® 2HCl (g)
Phản ứng này là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 19:
20/07/2024Cho các phát biểu sau:
(1). Tất cả các phản ứng cháy đều thu nhiệt.
(2). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(3). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(4). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 20:
20/07/2024Cho phản ứng sau:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 21:
16/07/2024Cho giản đồ năng lượng của các phản ứng 1 – 5 như sau:
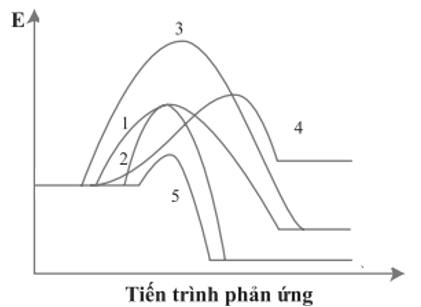
Số phản ứng toả nhiệt là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 22:
22/07/2024Ở nhiệt độ 25oC và áp suất 1 bar, trong số các đơn chất halogen sau, đơn chất có enthalpy tạo thành chuẩn khác 0 là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 23:
20/07/2024Ở điều kiện chuẩn, phản ứng có biến thiên enthalpy của phản ứng bằng enthalpy tạo thành của chất sản phẩm là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 24:
23/07/2024Cho phản ứng sau:
2CO(g) + O2(g) → 2CO2(g)
Biết (kJ mol-1) của CO(g) và CO2(g) lần lượt là –110,53 và –393,51. Lượng nhiệt giải phóng khi chuyển 56 gam khí CO thành khí CO2 là
 Xem đáp án
Xem đáp án
nCO = 2 mol.
Vậy lượng nhiệt giải phóng khi tạo 2 mol CO chính bằng :
= |2. (–393,51) – 2. (–110,53)| = 565,96 kJ.
Câu 25:
22/07/2024Cho phản ứng sau:
2NaCl(s) → 2Na(s) + Cl2(g)
Biết (kJ mol-1) của NaCl là –411,2. Trong quá trình nấu ăn, dù bị đun nóng nhưng muối ăn không bị phân hủy thành khí Cl2 độc, vì
 Xem đáp án
Xem đáp án
= –2.= –2. (–411,2) = 822,4 kJ.
rất dương nên phản ứng không thuận lợi xảy ra.
Câu 26:
23/07/2024Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
 Xem đáp án
Xem đáp án
Ta có: = EN≡N + 3.EH–H – 6.EN–H
ÞCâu 27:
21/07/2024Cho phản ứng: C3H8(g) ⟶ CH4(g) + C2H4(g).
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn được cho ở bảng sau:
|
Liên kết |
C – H |
C – C |
C = C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Nhận xét nào sau đây là sai?
 Xem đáp án
Xem đáp án
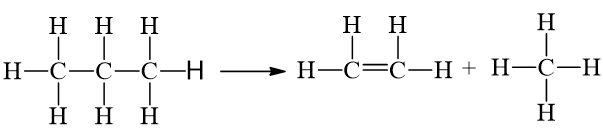
= 2.346 + 8.418 - 1.612 - 8.418 = +80 kJ.
Phản ứng là thu nhiệt do
Þ Phát biểu D sai.
Câu 28:
22/07/2024Cho phản ứng: N2(g) + O2(g) → 2NO(g). Biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Phát biểu đúng là
 Xem đáp án
Xem đáp án
N2(g) + O2(g) → 2NO(g)
= (945.1 + 494.1) – 607.2 = 225 (kJ).
> 0, phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có
tia lửa điện.
Câu 29:
17/07/2024Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) HI + H2SO4 → SO2 + I2 + H2O.
 Xem đáp án
Xem đáp án
a)
Chất khử: HI; Chất oxi hoá: H2SO4.
Ta có các quá trình:
Phương trình hoá học:
2HI + H2SO4 → SO2 + I2 + 2H2O
Câu 30:
18/07/2024Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
b) Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O.
 Xem đáp án
Xem đáp án
b)
Chất khử: Al; Chất oxi hoá: HNO3.
Ta có các quá trình:
Phương trình hoá học:
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Câu 31:
23/07/2024Tính lượng nhiệt tỏa ra ở điều kiện chuẩn khi đốt cháy 2 gam butane (C4H10) chứa trong một chiếc bật lửa gas. Biết sản phẩm của sự đốt cháy là khí carbon dioxide và hơi nước.
Cho của C4H10 (g), CO2 (g) và H2O (l) lần lượt là –126,15 kJ mol-1, –393,51 kJ mol-1 và –285,83 kJ mol-1.
 Xem đáp án
Xem đáp án
Phản ứng đốt cháy butane:
C4H10 (g) + O2 (g) → 4CO2 (g) + 5H2O (l)
= 4.+ 5. –
= 4.(–393,51) + 5.(–285,83) – (–126,15)
= –2877,04 kJ
= = mol
Lượng nhiệt tỏa ra ở điều kiện chuẩn khi đốt cháy 2 gam butane có giá trị là:
Qtỏa =.(–2877,04) = –99,21 kJ.
Câu 32:
23/07/2024Quá trình đốt cháy ethanol diễn ra theo phản ứng:
C2H5OH (l) + 3O2 (g) → 2CO2 (g) + 3H2O (l)
Tính của phản ứng trên từ các giá trị năng lượng liên kết sau:
EC–C = 347 kJ mol-1; EO=O = 496 kJ mol-1; EC–O = 336 kJ mol-1; EC–H = 410 kJ mol-1; EC=O = 805 kJ mol-1; EO–H = 465 kJ mol-1.
 Xem đáp án
Xem đáp án
Các liên kết trong C2H5OH gồm: 5 liên kết C-H, 1 liên kết C-C, 1 liên kết C-O và 1 liên kết O-H.
Ta có: = ΣEb (cđ) – ΣEb (sp)
= (5.EC–H + EC–C + EC–O + EO–H + 3.EO=O) – (4.EC=O + 6.EO–H)
= (5.410 + 347 + 336 + 465 + 3.496) – (4.805 + 6.465)
= –1324 kJ.
Bài thi liên quan
-
Đề kiểm tra Giữa học kì 2 Hóa 10 Cánh diều có đáp án - Đề 1
-
32 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề kiểm tra Giữa học kì 2 Hóa 10 Cánh diều có đáp án (1086 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra giữa học kì 1 Hóa học 10 CD có đáp án (251 lượt thi)
- Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án (250 lượt thi)
