Bài tập Thực hành tính tham số cấu trúc và năng lượng có đáp án
Bài tập Thực hành tính tham số cấu trúc và năng lượng có đáp án
-
75 lượt thi
-
10 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
13/07/2024Không dùng máy móc thí nghiệm, bằng máy tính làm thể nào để giải thích mối quan hệ giữa cấu tạo phân tử và tính chất của chất?
 Xem đáp án
Xem đáp án
Trả lời:
Không dùng máy móc thí nghiệm, bằng máy tính để giải thích mối quan hệ giữa cấu tạo phân tử và tính chất của chất thì chúng ta dựa vào các phần mềm tính toán hóa học như phần mềm MOPAC, …
Câu 2:
15/07/2024Tạo file dữ liệu để tối ưu hóa cấu trúc của phân tử H2O.
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành
Bước 1. Sử dụng Notepad hoặc Wordpad tạo file dữ liệu. File dữ liệu để tối ưu hoá cấu trúc của phân tử và tính nhiệt hình thành của phân tử H2O có nội dung như sau:

Trong đó:
- Từ khóa AM1 là để sử dụng phương pháp bán kinh nghiệm AM1.
- Từ khoá OPT là để tối ưu hoá cấu trúc hình học. Từ ENPART là để tính năng lượng phân tử.
- Cấu trúc hình học của phân tử H2O ở file dữ liệu này được hiểu như sau: Nguyên tử thứ nhất là oxygen (O1) được mô tả ở hàng thứ nhất. Nguyên tử thứ 2 là hydrogen (H(2)) được mô tả ở hàng thứ hai. H(2) liên kết với O(1) bằng liên kết có độ dàỉ 0.97 ![]() . Nguyên tử thứ 3 là hydrogen (H(3)) được mô tả ở hàng thứ ba, H(3) liên kết với O(1) bằng liên kết có độ dài 0.97
. Nguyên tử thứ 3 là hydrogen (H(3)) được mô tả ở hàng thứ ba, H(3) liên kết với O(1) bằng liên kết có độ dài 0.97 ![]() . Góc H(3)O(1)H(2) = 104,5o.
. Góc H(3)O(1)H(2) = 104,5o.
- Số 0 đứng sau mỗi giá trị độ dài liên kết hay góc liên kết có nghĩa là độ dài liên kết hay góc liên kết này được giữ có định.
- Số 1 đứng sau mỗi giá trị độ dài liên kết hay góc liên kết có nghĩa là độ dài liên kết hay góc liên kết này sẽ được tối ưu
Bước 2: Lưu file dữ liệu vào thư mục “D\Nguyen Van A\MOPAC_Working”. Kiểu file là “.txt”. Ví dụ: “H2O_AM1.txt” ⟶ Đóng file vừa soạn thảo “H2O.AM1.txt”.
Câu 3:
13/07/2024Tối ưu hóa cấu trúc của phân tử H2O bằng phương pháp bán kinh nghiệm.
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành:
- Bước 1. Đổi file dữ liệu đã tạo (ở hoạt động 1) sang dạng đuôi “.mop”, ví dụ: “H2O_AM1.mop”. Vào thư mục “D:\Nguyen_Van_A\MOPAC_Working”, nháy chuột phải chọn Rename rồi thay đuôi ".txt" thành đuôi ".mop".
- Bước 2. Nháy chuột phải vào file "H2O_AM1.mop"
Chọn Open with ⟶ MOPAC2016.exe.
Lúc này file dữ liệu “H2O_AM1.mop" được chạy bằng MOPAC. Sau khi chạy xong, xuất hiện file kết quả tính "H2O_AM1.out" trong thư mục "D:\Nguyen_Van_A\MOPAC_ Working".
Câu 4:
13/07/2024Đọc file kết quả và sử dụng kết quả tính tối ưu hóa cấu trúc của phân tử, tính nhiệt tạo thành và năng lượng phân tử của H2O.
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành:
Nháy chuột phải vào file “H2O_AM1.out”, chọn Open with Wordpad.
Đoạn văn bản đầu của file như sau:

Đoạn văn bản kết thúc file “H2O_AM1.out” như sau:

Giá trị nhiệt tạo thành của phân tử H2O (thể hơi) ở file “H2O_AM1.out”.
FINAL HEAT OF FORMATION= -59.25050 KCAL/MOL = -247.90410 KJ/MOL
Giá trị này khá gần đúng so với giá trị thực nghiệm. Theo thực nghiệm, nhiệt tạo thành của phân tử H2O(thể hơi) là –241,826 kJ/mol.
Giá trị năng lượng phân tử của H2O (thề hơi), kí hiệu là ETOT (EONE + ETWO) ở file "H2O_AM1.out":
ETOT (EONE + ETWO) -348.5632 EV
Câu 5:
13/07/2024 Xem đáp án
Xem đáp án
Trả lời:
Nháy chuột phải vào file “H2O_AM1.out”, chọn Open with Wordpad, đi đến đoạn văn bản sau:
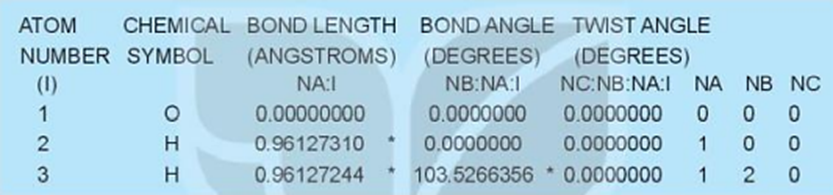
Đoạn văn bản này cho biết độ dài liên kết (bond length) và góc liên kết (bond angle) của phân tử H2O.
Câu 6:
22/07/2024Xác định độ dài liên kết O-H và góc liên kết trong phân tử nước, tính tối ưu được theo phương pháp AM1. Hãy so sánh chúng với giá trị thực nghiệm độ dài liên kết O – H.
(0,97 ) và góc liên kết (104,5o).
 Xem đáp án
Xem đáp án
Trả lời:
Từ bảng kết quả ở hoạt động 4, chúng ta thấy:
- Độ dài liên kết O – H là 0,96127244
- Góc liên kết là 103,5266356 o
⇒ Các giá trị này khá gần đúng so với giá trị thực nghiệm.
Câu 7:
20/07/2024Sử dụng kết quả tính tối ưu hóa cấu trúc để thấy được cấu trúc hình học của phân tử H2O.
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành:
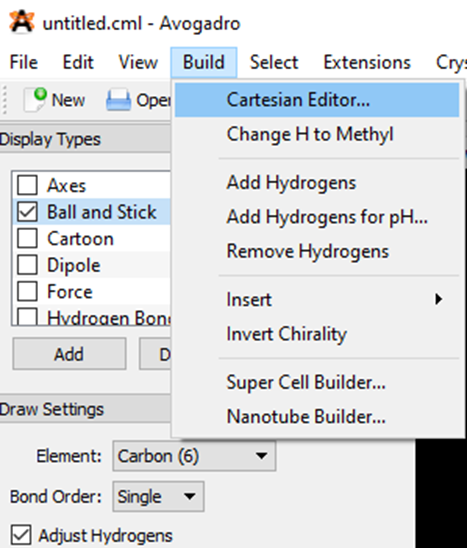
Bước 1. Mở phần mềm Avogadro. Chọn lệnh File ⟶ New ⟶ Display Settings (Cài đặt hiển thị) ⟶ Display Types (Kiểu hiển thị) ⟶ Ball and Stick (Quả cầu và que nối). Sau đó chọn lệnh Build ⟶ Cartesian Editor (Hình 11.1a), một cửa sổ xuất hiện cho phép dán toạ độ Descartes của phân tử để hiển thị cấu trúc.
Bước 2. Mỡ file kết quả tính "H2O_AM1.out" thu được ở trên, đi đến đoạn văn bản sau:
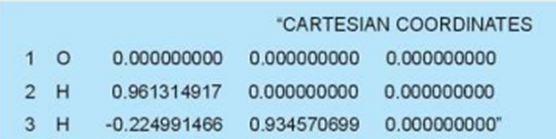
Bước 3. Copy các dòng toạ độ Descartes này dán sang vị trí mô tả toạ độ Descartes tương ứng ở cửa sổ Cartesian Editor của giao diện Avogadro. Nháy chuột vào Apply rồi nháy vào giao diện Avogadro, hình ảnh cấu trúc hình học phân tử H2O xuất hiện trên màn hình Avogadro
Các bước hiển thị các tham số cấu trúc:
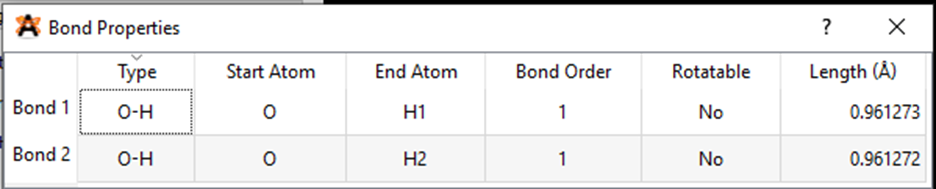
• Hiển thị độ dài các liên kết
Chọn lệnh View→ Properties ⟶ Bond Properties.
Một bảng số liệu độ dài của các liên kết xuất hiện ở màn hình
• Hiển thị góc các liên kết
Chọn lệnh View ⟶ Properties ⟶ Angle Properties.
Một bảng số liệu các góc liên kết xuất hiện ở màn hình, nói tiếp phía dưới của độ dài liên kết.
Lưu ý: Các giá trị kết quả mà em thu được có thể có sai khác so với kết quả trên.
Câu 8:
13/07/2024Tạo file dữ liệu và thực hiện phép tính tối ưu hoá cấu trúc của phân tử, tính nhiệt hình thành và năng lượng phân tử của NH3, CH4.
Hướng dẫn:
File dữ liệu để tối ưu hoả cấu trúc, tinh nhiệt hình thành và năng lượng phân tử của NH3 bằng phần mềm MOPAC có nội dung như sau:
Trong đó 120.0 là giá trị góc nhị diện của hai mặt phẳng: H(4)N(2)H(3) và N(2)H(3)H(1). Cách tiến hành: thực hiện theo các bước như ở Hoạt động 1, Hoạt động 2 và Hoạt động 3, ở các mục II, III.
 Xem đáp án
Xem đáp án
Trả lời:
Bước 1. Vào Notepad, gõ lại nội dung để tối ưu hóa ⟶ Lưu file với đuôi “.txt”
Bước 2. Đổi đuôi file thành “.mop”
Bước 3. Chọn file vừa đổi đuôi, nháy chuột phải ⟶ Chọn Open with ⟶ Choose another app ⟶ MOPAC2016. Khi này sẽ có 1 file đuôi “.out”.
Bước 4. Chọn file đuôi “.out” ⟶ Chuột phải ⟶ Open with ⟶ Notepad hoặc WordPad.
Bước 5. Đọc kết quả
Giá trị nhiệt tạo thành của phân tử NH3 (thể khí) ở file “NH3_AM1.out” là:
Giá trị năng lượng phân tử của NH3 (thể khí), kí hiệu là ETOT (EONE + ETWO) ở file “NH3_AM1.out” là:

Phân tử CH4
Bước 1. Vẽ cấu trúc phân tử CH4. Ở phía trái giao diện phần mềm Avogadro, chọn Draw Settings ⟶ Element, chọn nguyên tố carbon. Nháy chuột vào màn hình Avogadro, cấu trúc phân tử CH4 được hiển thị.
Bước 2. Chọn Extensions ⟶ MOPAC ⟶ Nhập Title, Method chọn là AM1, Calculation chọn Geomtry Optimization ⟶ Chọn Generate.
Bước 3. Tiến hành lưu file
Bước 4. Chọn mở file vừa lưu bằng MOPAC 2016 sẽ có file out xuất hiện.
Bước 5. Mở file đuôi “.out” bằng Notepad hoặc WordPad.
Bước 6. Đọc kết quả
Giá trị nhiệt tạo thành của phân tử CH4 (thể khí) là:
Câu 9:
13/07/2024Sử dụng kết quả tính tối ưu hóa cấu trúc để thấy được cấu trúc hình học, hiển thị được các tham số cấu trúc của phân từ NH3, CH4. Từ đó, thấy được xu hướng biến đổi độ dài liên kết H−X và góc liên kết HXH (X là O, N, C).
Hướng dẫn. Thực hiện theo các bước như ở Hoạt động 4, Hoạt động 5, mục III.
 Xem đáp án
Xem đáp án
Trả lời:
Kết quả độ dài liên kết C – H và góc liên kết HCH là:
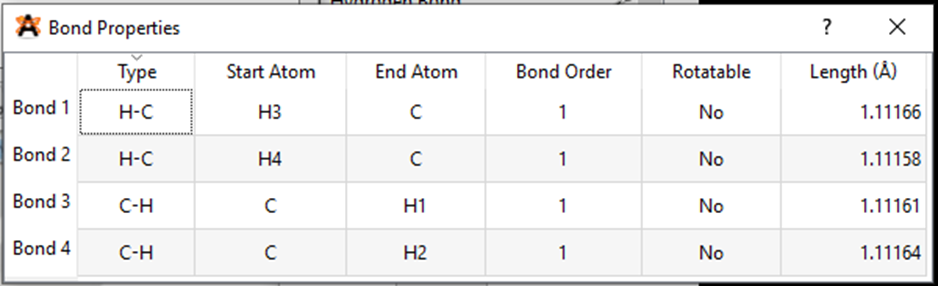
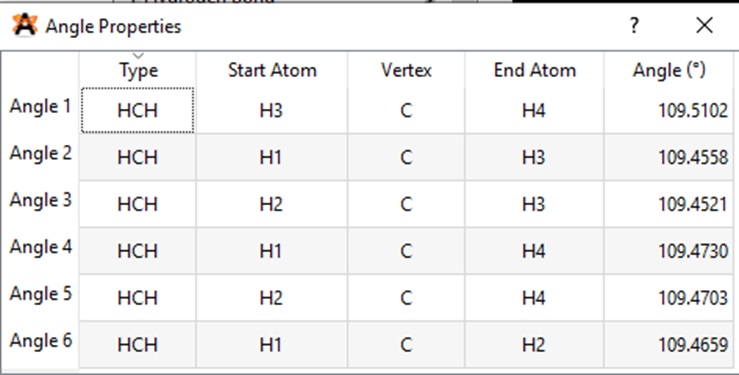
Kết quả độ dài liên kết N – H và góc liên kết HNH là:
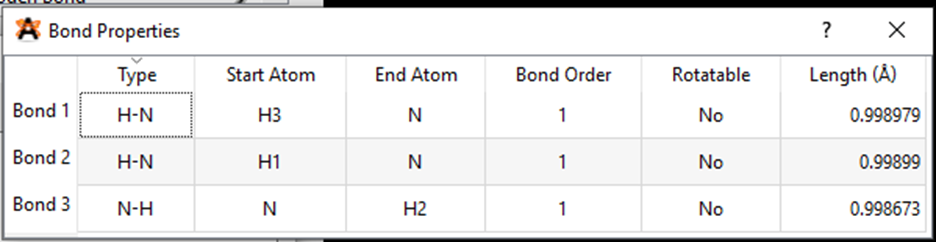
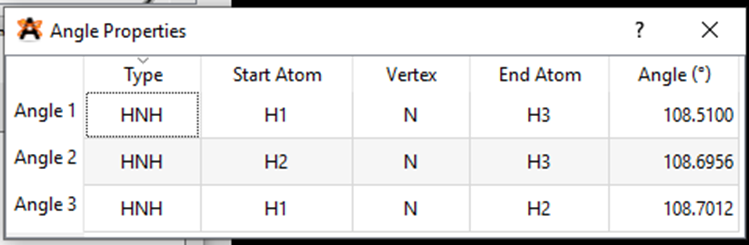
Từ kết quả thí nghiệm ta thấy, độ dài liên kết C – H lớn hơn độ dài liên kết N – H và góc liên kết thì giống nhau.
Câu 10:
13/07/2024Sử dụng kết quả tính toán đề thấy được xu hướng thay đổi độ dài liên kết, góc liên kết, năng lượng phân tử trong dãy chất, ví dụ CH4, NH3, H2O phù hợp với định luật tuần hoàn.
 Xem đáp án
Xem đáp án
Trả lời:
Từ kết quả ta thấy:
- Độ dài liên kết giảm dần từ H2O < NH3 < CH4 và điều này phù hợp với định luật tuần hoàn.
Giải thích:
Các nguyên tử O, N, C đều liên kết với H bằng cách góp chung electron, mà độ âm điện tăng dần từ C, N, O và bán kính nguyên tử giảm dần từ C, N, O nên độ dài liên kết CH4 > NH3 > H2O.
- Góc liên kết tăng dần theo thứ tự: H2O, NH3, CH4.
Giải thích:
+ Do trong 3 phân tử H2O, NH3, CH4, nguyên tử trung tâm đều lai hóa sp3, phân tử CH4 có cấu tạo tứ diện, góc HCH = 109o28’, còn trong phân tử H2O và NH3 góc bị ép lại nhỏ hơn 109o28’ do sự đẩy nhau giữa 2 cặp electron không liên kết lớn nhất, sau đó đến sự đẩy nhau giữa electron không liên kết với electron liên kết, cuối cùng là sự đẩy giữa hai mây electron liên kết là yếu nhất.
+ Trong H2O, O còn 2 cặp electron chưa tham gia liên kết còn trong NH3, N có 1 cặp electron chưa liên kết nên góc liên kết của H2O nhỏ hơn NH3.
- Năng lượng phân tử âm dần theo thứ tự: CH4, NH3, H2O
Năng lượng tổng càng âm phân tử càng bền. Phù hợp với sự biến đổi độ âm điện. Độ âm điện tăng dần theo thứ tự C, N, O nên lực hút giữa các nguyên tử đó với H tăng dần