Giải Hóa học 12 Bài 14 (Chân trời sáng tạo): Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại
Với giải bài tập Hóa học 12 Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 12 Bài 14.
Giải Hóa học 12 Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại
Mở đầu trang 75 Hóa học 12: Kim loại giữ vai trò quan trọng trong các ngành kĩ thuật vì chúng có những tính chất vật lí, hoá học đặc biệt. Kim loại có cấu tạo nguyên tử như thế nào? Có những tính chất và ứng dụng gì?
Lời giải:
- Cấu tạo nguyên tử: Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim. Đa số các nguyên tử kim loại có số electron ở lớp ngoài cùng là 1,2, 3.
- Tính chất:
+ Tính chất vật lí chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và tính dẻo.
+ Tính chất hóa học:
· Kim loại tác dụng với phi kim.
· Kim loại tác dụng với dung dịch acid.
· Kim loại tác dụng với nước.
· Kim loại tác dụng với dung dịch muối.
- Ứng dụng: một số kim loại được dùng làm đồ trang sức hay làm các vật dụng trang trí; kim loại có tính dẫn điện tốt được dùng làm dây dẫn điện như Cu, Al; kim loại có tính dẫn nhiệt tốt có thể được dùng làm dụng cụ đun nấu…
Câu hỏi 1 trang 75 Hóa học 12: Hãy nêu nhận xét về số electron lớp ngoài cùng của các nguyên tử kim loại Na, Mg, Al, Fe, Cu, Zn.
Lời giải:
Các nguyên tử kim loại trên có số electron ở lớp ngoài cùng là 1 (như Na, Cu), 2 (như Mg, Fe, Zn), 3 (như Al).
Câu hỏi 2 trang 76 Hóa học 12: So sánh liên kết kim loại với liên kết ion và liên kết cộng hoá trị.
Lời giải:
* So sánh liên kết kim loại với liên kết cộng hóa trị:
- Giống nhau: có sự dùng chung electron.
- Khác nhau:
+ Liên kết cộng hóa trị: dùng chung electron giữa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: dùng chung toàn bộ electron hóa trị trong nguyên tử kim loại.
* So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
Câu hỏi 3 trang 77 Hóa học 12: Vàng, bạc được sử dụng làm đồ trang sức nhờ tính chất vật lí nào của kim loại?
Lời giải:
Vàng, bạc được sử dụng làm đồ trang sức nhờ tính chất vật lí ánh kim và tính dẻo của kim loại.
Câu hỏi 4 trang 77 Hóa học 12: Hãy cho biết hiện tượng xảy ra khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại. Giải thích.
Lời giải:
Khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại, kim loại sẽ bị biến dạng vì kim loại có tính dẻo nhờ electron tự do liên kết các lớp mạng trong tinh thể với nhau và chúng có thể trượt lên nhưng không tách rời nhau.
Luyện tập trang 78 Hóa học 12: Hãy giải thích:
a) Tại sao tungsten (W) được dùng để làm dây tóc bóng đèn?
b) Tại sao lõi dây điện thường được làm từ kim loại đồng?
Lời giải:
a) Người ta sử dụng tungsten (W) được dùng để làm dây tóc bóng đèn vì tungsten là kim loại có nhiệt độ nóng chảy cao nhất.
b) Đồng có tính dẫn điện tốt (chỉ sau bạc), giá thành rẻ hơn bạc nên được sử dụng để làm lõi dây điện.
Câu hỏi 5 trang 78 Hóa học 12: Tiến hành Thí nghiệm 1 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở thí nghiệm này.
Phương pháp giải:
Hầu hết các kim loại (trừ Au, Pt,...) có thể phản ứng với chlorine tạo thành muối chloride.
Hầu hết các kim loại có thể phản ứng với oxygen (trừ Ag, Au, Pt) tạo thành các oxide tương ứng.
Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg).
Lời giải:
- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với chlorine: Sắt cháy sáng tạo thành khói màu nâu đỏ.
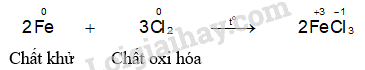
- Hiện tượng phản ứng của thí nghiệm magnesium phản ứng với oxygen: Magnesium cháy sáng chói, toả nhiều nhiệt.
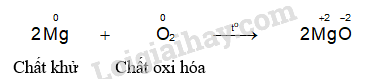
- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với lưu huỳnh: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
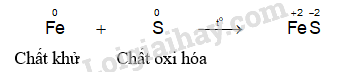
Câu hỏi 6 trang 79 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2.
Lời giải:
Những kim loại có < 0 có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2: Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb.
Câu hỏi 7 trang 79 Hóa học 12: Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 2.
Lời giải:
- Ống nghiệm (1): Không hiện tượng.
- Ống nghiệm (2): Xuất hiện bọt khí không màu, sắt tan dần và dung dịch chuyển sang màu xanh nhạt.

- Ống nghiệm (3): Không hiện tượng.
- Ống nghiệm (4): Xuất hiện bọt khí không màu, sắt tan dần và dung dịch chuyển sang màu xanh nhạt.
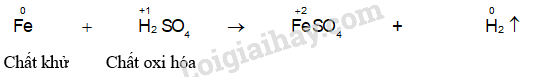
- Ống nghiệm (5): Mẩu kim loại đồng tan dần, xuất hiện bọt khí không màu, mùi hắc, dung dịch chuyển sang màu xanh lam.

Câu hỏi 8 trang 80 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với nước ở điều kiện thường giải phóng khí H2.
Phương pháp giải:
Kim loại có < -0,42 có thể phản ứng với H2O tạo thành base và khí H2.
Lời giải:
Kim loại có thể phản ứng với H2O ở điều kiện thường giải phóng khí H2: Li, K, Ba, Ca, Na.
Câu hỏi 9 trang 80 Hóa học 12: Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M.
Lời giải:
Kim loại có < 0,34 và không phản ứng với nước ở điều kiện thường, có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M là Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb.
Câu hỏi 10 trang 80 Hóa học 12: Tiến hành Thí nghiệm 3 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 3.
Lời giải:
- Ống nghiệm (1): Kết tủa màu xám bạc bám vào mẩu đồng. Dung dịch ban đầu không màu chuyển dần sang màu xanh.
Chất khử Chất oxi hóa
- Ống nghiệm (2): Không hiện tượng.
Bài tập
Bài 1 trang 80 Hóa học 12: Thuỷ ngân dễ bay hơi và rất độc. Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lí thuỷ ngân. Giải thích.
Lời giải:
Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lí thuỷ ngân vì lưu huỳnh phản ứng với thủy ngân ngay ở nhiệt độ thường, tạo ra chất rắn HgS không độc, có thể quét dọn được.
Bài 2 trang 80 Hóa học 12: Tại sao đồng dẫn điện tốt hơn nhôm nhưng dây điện cao thế thường được làm bằng nhôm mà không làm bằng đồng? cho biết khối lượng riêng của đồng là 8,96 g/cm3, của nhôm là 2,70 g/cm3.
Lời giải:
Dây điện cao thế thường sử dụng nhôm vì nhôm nhẹ hơn đồng, làm giảm áp lực lên cột điện, cột điện đỡ bị gãy. Ngoài ra, giá nhôm cũng rẻ hơn so với đồng.
Bài 3 trang 80 Hóa học 12: Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Giải thích và viết phương trình hoá học của các phản ứng xảy ra (nếu có).
Lời giải:
- Giải thích: Các kim loại thiếc, kẽm đều có thế điện cực chuẩn nhỏ hơn đồng nên thiếc và kẽm có thể đẩy được đồng ra khỏi dung dịch muối đồng. Vì vậy để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Thiếc và kẽm tan trong dung dịch Cu(NO3)2, tạo thêm kết tủa đồng, lọc hỗn hợp ta thu được kim loại đồng tinh khiết.
- Phương trình hóa học:
Xem thêm các chương trình khác:
- Soạn văn 12 Chân trời sáng tạo (hay nhất)
- Văn mẫu 12 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 12 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn 12 - Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 12 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn 12 – Chân trời sáng tạo
- Giải sgk Toán 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 12 – Chân trời sáng tạo
- Lý thuyết Toán 12 – Chân trời sáng tạo
- Giải sbt Toán 12 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 12 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh lớp 12 Friends Global đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 Friends Global đầy đủ nhất
- Giải sbt Tiếng Anh 12 – Friends Global
- Giải sgk Lịch sử 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 12 – Chân trời sáng tạo
- Giải sbt Lịch sử 12 – Chân trời sáng tạo
- Giải sgk Địa lí 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 12 – Chân trời sáng tạo
- Giải sbt Địa lí 12 – Chân trời sáng tạo
- Giải sgk Tin học 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Tin học 12 – Chân trời sáng tạo
- Giải sbt Tin học 12 – Chân trời sáng tạo
- Lý thuyết Tin học 12 - Chân trời sáng tạo
- Giải sgk Công nghệ 12 – Chân trời sáng tạo
- Giải sgk Kinh tế pháp luật 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 12 – Chân trời sáng tạo
- Giải sgk Giáo dục quốc phòng 12 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 12 – Chân trời sáng tạo
- Giải sgk Vật lí 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 12 – Chân trời sáng tạo
- Lý thuyết Vật lí 12 – Chân trời sáng tạo
- Giải sbt Vật lí 12 – Chân trời sáng tạo
- Giải sgk Sinh học 12 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 12 – Chân trời sáng tạo
- Lý thuyết Sinh học 12 – Chân trời sáng tạo
- Giải sbt Sinh học 12 – Chân trời sáng tạo
