Đốt cháy 28 ml hỗn hợp khí metan và axetilen
Với giải bài 4 trang 122 sgk Hóa học lớp 9 được biên soạn lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập môn Hóa 9. Mời các bạn đón xem:
Giải Hóa 9 Bài 38: Axetilen
Video Giải Bài 4 trang 122 SGK Hóa học lớp 9
Bài 4 trang 122 SGK Hóa học lớp 9: Đốt cháy 28 ml hỗn hợp khí metan và axetilen cần phải dùng 67,2 ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
Lời giải:
Do các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Gọi thể tích metan (CH4) là x (ml); thể tích axetilen (C2H2) là y (ml)
Theo bài ra: Vhh khí = 28 (ml)
→ x + y = 28 (1)
Phương trình phản ứng:
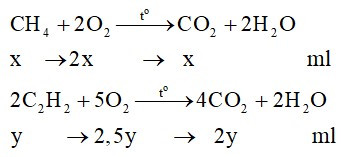
Theo bài, thể tích khí oxi là 67,2 ml
→ 2x + 2,5y = 67,2 (2)
Từ (1) và (2) giải hệ phương trình được: x = 5,6 (ml) và y = 22,4 (ml).
a) Phần trăm thể tích từng khí là:
b/ Theo phương trình phản ứng ở trên có:
Thể tích khí CO2 = x + 2y = 5,6 + 2.22,4 = 50,4 (ml).
Xem thêm lời giải bài tập Hóa học lớp 9 hay, chi tiết khác:
Bài 1 trang 122 SGK Hóa 9: Hãy cho biết trong các chất sau...
Bài 2 trang 122 SGK Hóa 9: Cần bao nhiêu ml dung dịch brom 0,1M để tác dụng...
Bài 3 trang 122 SGK Hóa 9: Biết rằng 0,1 lít khí etilen (đktc) làm mất màu 50 ml...
Bài 5 trang 122 SGK Hóa 9: Cho 0,56 lít (đktc) hỗn hợp khí gồm...
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
