Đề cương Giữa học kì 2 Hoá học lớp 12 năm 2022 chi tiết nhất
Đề cương ôn tập Giữa học kì 2 Hoá học lớp 12 chi tiết nhất giúp học sinh củng cố thêm kiến thức để học tốt môn Hóa 12. Mời các bạn đón xem:
Đề cương Giữa học kì 2 Hoá học lớp 12 năm 2022 chi tiết nhất
Đề thi Giữa học kì 2 Hoá học lớp 12 năm 2022 có ma trận
|
Nội dung kiến thức
|
Mức độ nhận thức |
Cộng |
|||||||
|
Nhận biết |
Thông hiểu |
Vận dụng thấp |
Vận dụng cao |
||||||
|
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
||
|
1. Sự ăn mòn kim loại |
|
- Các khái niệm: ăn mòn kim loại, ăn mòn hoá học, ăn mòn điện hoá. - Điều kiện xảy ra sự ăn mòn kim loại. Các biện pháp bảo vệ kim loại khỏi bị ăn mòn. |
- Phân biệt được ăn mòn hoá học và ăn mòn điện hoá ở một số hiện tượng thực tế. - Sử dụng và bảo quản hợp lí một số đồ dùng bằng kim loại và hợp kim dựa vào những đặc tính của chúng. - Giải thích cơ chế ăn mòn điện hoá học trong thực tế. |
|
|
||||
|
Số câu hỏi |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
2 |
|
Số điểm |
0 |
0 |
0,33 |
0 |
0,33 |
0 |
0 |
0 |
0,67 |
|
Tỉ lệ % |
0% |
0 |
3,33% |
0 |
3,33% |
0 |
0 |
0 |
6,67% |
|
2. Điều chế kim loại |
- Nhận ra các phương pháp điều chế kim loại (thủy luyện, nhiệt luyện, điện phân) - Biết các phản ứng điều chế một số kim loại điển hình (Na, Mg, Al, Fe, Cu...) |
- Nguyên tắc điều chế kim loại. - Các phương pháp điều chế kim loại (điện phân, nhiệt luyện, thủy luyện).
|
- Lựa chọn được phương pháp điều chế kim loại cụ thể cho phù hợp từ hợp chất hoặc hỗn hợp. - Quan sát thí nghiệm, hình ảnh, sơ đồ... để rút ra nhận xét về phương pháp điều chế kim loại. - Viết các PTHH điều chế kim loại. - Tính khối lượng nguyên liệu sản xuất được một lượng kim loại xác định theo hiệu suất hoặc ngược lại. - Bài toán điện phân có sử dụng biểu thức Farađây. |
|
|
||||
|
Số câu hỏi |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
3 |
|
Số điểm |
0,33 |
0 |
0,33 |
0 |
0,33 |
0 |
0 |
0 |
1 |
|
Tỉ lệ % |
3,33% |
0 |
3,33% |
0 |
3,33% |
0 |
0 |
0 |
10% |
|
3. Kim loại kiềm và hợp chất quan trọng của kim loại kiềm |
− Kí hiệu hóa học, vị trí, cấu hình electron lớp ngoài cùng của kim loại kiềm. - Cách bảo quản kim loại kiềm - Gọi tên các kim loại kiềm và hợp chất của chúng. - Công thức các hợp chất của kim loại kiềm. - Xác định số oxi hóa của kim loại kiềm. - Biết sản phẩm phản ứng của kim loại kiềm với H2O. − Một hợp chất quan trọng của kim loại kiềm như: NaOH, NaHCO3, Na2CO3, KNO3 (đã học lớp dưới) |
− Tính chất vật lí (mềm, khối lượng riêng nhỏ, nhiệt độ nóng chảy thấp). − Tính chất hoá học: Tính khử mạnh nhất trong số các kim loại (phản ứng với nước, axit, phi kim). - Tính chất hoá học của một số hợp chất: NaOH (kiềm mạnh); NaHCO3 (lưỡng tính, phân huỷ bởi nhiệt); Na2CO3 (muối của axit yếu); KNO3 (tính oxi hoá mạnh khi đun nóng). |
− Dự đoán tính chất hoá học, kiểm tra và kết luận về tính chất của đơn chất và một số hợp chất kim loại kiềm. − Quan sát thí nghiệm, hình ảnh, sơ đồ rút ra được nhận xét về tính chất, phương pháp điều chế. − Viết các phương trình hoá học minh hoạ tính chất hoá học của kim loại kiềm và một số hợp chất của chúng. - Viết sơ đồ điện phân điều chế kim loại kiềm. - Bài toán tính theo phương trình, xác định kim loại kiềm và tính thành phần hỗn hợp. |
|
|
||||
|
Số câu hỏi |
4 |
0 |
2 |
0 |
1 |
0 |
0 |
0 |
7 |
|
Số điểm |
1,33 |
0 |
0,67 |
0 |
0,33 |
0 |
0 |
0 |
2,33 |
|
Tỉ lệ % |
13,3% |
0 |
6,7% |
0 |
3,3% |
0 |
0% |
0 |
23,3% |
|
4. Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ |
− Kí hiệu hóa học, tên gọi của kim loại kiềm thổ. - Vị trí, cấu hình electron lớp ngoài cùng. - Tính chất vật lí của kim loại kiềm thổ và hợp chất. - Biết sản phẩm của phản ứng của kim loại với phi kim (oxi, clo), HCl, H2O. - Trạng thái tự nhiên của các hợp chất canxi. − Khái niệm về nước cứng (tính cứng tạm thời, vĩnh cửu, toàn phần), tác hại của nước cứng, cách làm mềm nước cứng. − Cách nhận biết ion Ca2+, Mg2+ trong dung dịch. |
- Kim loại kiềm thổ có tính khử mạnh (tác dụng với oxi, clo, axit, muối). − Tính chất hoá học các hợp chất của canxi. - Ứng dụng của Ca(OH)2, CaCO3, CaSO4.2H2O.
|
− Dự đoán, kiểm tra dự đoán bằng thí nghiệm và kết luận được tính chất hoá học chung của kim loại kiềm thổ, tính chất của Ca(OH)2. − Viết các phương trình hoá học dạng phân tử và ion thu gọn minh họa tính chất hoá học. - Viết phương trình điều chế kim loại kiềm thổ từ các hợp chất - Bài toán tính theo PTHH, xác định kim loại kiềm thổ và tính thành phần hỗn hợp.
|
- Thực hiện sơ đồ chuyển hóa. - Tính khối lượng của kim loại kiềm thổ và hợp chất trong hỗn hợp. |
|
||||
|
Số câu hỏi |
5 |
0 |
2 |
0 |
1 |
0 |
1 |
0 |
9 |
|
Số điểm |
1,67 |
0 |
0,67 |
0 |
0,33 |
0 |
0,33 |
0 |
3 |
|
Tỉ lệ % |
16,7% |
0 |
6,7% |
0 |
3,3% |
0 |
3,3% |
0 |
30% |
|
5. Nhôm và hợp chất của nhôm |
- Vị trí trong bảng tuần hoàn, cấu hình lớp electron ngoài cùng của nhôm. - Tính chất vật lí, trạng thái tự nhiên, ứng dụng của nhôm. - Biết sản phẩm của phản ứng giữa nhôm với O2, Cl2, HCl, oxit kim loại, dd NaOH. - Công thức hóa học và tên gọi các hợp chất của nhôm. - Ứng dụng các hợp chất của nhôm.
|
− Nhôm là kim loại có tính khử khá mạnh: phản ứng với phi kim, dung dịch axit, nước, dung dịch kiềm, oxit kim loại. − Nguyên tắc và sản xuất nhôm bằng phương pháp điện phân oxit nóng chảy. − Tính chất vật lí và ứng dụng của một số hợp chất: Al2O3, Al(OH)3, muối nhôm. − Tính chất lưỡng tính của Al2O3, Al(OH)3: vừa tác dụng với axit mạnh, vừa tác dụng với bazơ mạnh. − Cách nhận biết ion nhôm trong dung dịch. - Bài toán tính theo một PTHH.
|
Quan sát mẫu vật, thí nghiệm, rút ra kết luận về tính chất hóa học của nhôm và hợp chất, nhận biết ion nhôm − Dự đoán, kiểm tra bằng thí nghiệm và kết luận được tính chất hóa học của nhôm, nhận biết ion nhôm. − Viết các PTHH phân tử và ion rút gọn (nếu có) minh hoạ tính chất hoá học của hợp chất nhôm. − Sử dụng và bảo quản hợp lý các đồ dùng bằng nhôm. − Tính khối lượng nhôm trong hỗn hợp chất đem phản ứng. - Tính khối lượng nhôm hiđroxit. − Tính khối lượng boxit để sản xuất lượng nhôm xác định theo hiệu suất phản ứng. |
- Hoàn thành sơ đồ chuyển hóa nhôm và hợp chất của nhôm. - Tính khối lượng nhôm, hợp chất của nhôm trong phản ứng nhiệt nhôm, trong hỗn hợp Al và hợp chất của Al. |
|
||||
|
Số câu hỏi |
3 |
0 |
2 |
0 |
1 |
0 |
1 |
0 |
7 |
|
Số điểm |
1 |
0 |
0,67 |
0 |
0,33 |
0 |
0,33 |
0 |
2,33 |
|
Tỉ lệ % |
10% |
0 |
6,7% |
0 |
3,3% |
0 |
3,3% |
0 |
23,3% |
|
6. Tổng hợp |
|
- Sự chuyển hóa các kim loại và hợp chất. - Liên hệ giữa ứng dụng và tính chất của các chất. |
|
- Hoàn thành sơ đồ chuyển hóa các hợp chất của kim loại kiềm, kiềm thổ, nhôm và hợp chất của chúng. Phân biệt các chất. − Tính khối lượng các chất có trong hỗn hợp kim loại kiềm, kiềm thổ, nhôm và hợp chất. |
|
||||
|
Số câu hỏi |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
0 |
2 |
|
Số điểm |
0 |
0 |
0,33 |
0 |
0 |
0 |
0,33 |
0 |
0,67 |
|
Tỉ lệ % |
0 |
0 |
3,3% |
0 |
0% |
0 |
3,3% |
0 |
6,7% |
|
Tổng số câu Tổng số điểm Tổng tỉ lệ % |
13
4,3
43% |
0
0
0 |
9
3
30% |
0
0
0 |
5
1,67
16,7% |
0
0
0% |
3
1
10% |
0
0
0% |
30
10
100% |
Đề thi Giữa học kì 2 Hoá học lớp 12 năm 2022 có ma trận đề số 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Fe = 56; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng;
(b) Đốt dây Fe trong bình đựng khí O2;
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
(d) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hóa là
A. 3.
B. 2.
C. 1.
D. 4.
Câu 2. Nhận xét nào sau đây là đúng?
A. Các nguyên tố nhóm IA đều là các kim loại kiềm.
B. Các kim loại nhóm IIA đều là phản ứng được với nước.
C. Các nguyên tố nhóm B đều là kim loại.
D. Khi kim loại bị biến dạng là do các lớp electron mất đi.
Câu 3. Sự thiếu hụt nguyên tố (ở dạng hợp chất) nào sau đây gây bệnh loãng xương?
A. Sắt.
B. Kẽm.
C. Canxi.
D. Photpho.
Câu 4. Trong số các kim loại sau, kim loại nào dẫn điện tốt nhất?
A. Cu.
B. Fe.
C. Al.
D. Au.
Câu 5. Ở nhiệt độ thường, kim loại X không tan trong nước nhưng tan trong dung dịch kiềm. Kim loại X là
A. Al.
B. Mg.
C. Ca.
D. Na.
Câu 6. Ion nào sau đây có tính oxi hóa mạnh nhất?
A. Ca2+.
B. Ag+.
C. Fe2+.
D. Zn2+.
Câu 7. Phương trình hóa học nào sau đây chỉ thực hiện bằng phương pháp điện phân?
A. Cu + 2AgNO3 → 2Ag + Cu(NO3)2.
B. Fe + 2FeCl3 → 3FeCl2.
C. MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
D. 2NaCl + 2H2O → H2 + 2NaOH + Cl2.
Câu 8. Cho 200 ml dung dịch NaOH 1M vào 120ml dung dịch Ca(HCO3)2 1M thu được a gam chất rắn. Giá trị của a gần nhất với giá trị nào sau đây?
A. 11,8.
B. 23,5.
C. 19,7.
D. 9,7.
Câu 9. Cho 3,8 gam hỗn hợp muối M2CO3 và MHCO3 (M là kim loại kiềm) vào dung dịch H2SO4 2M (dư), sinh ra 0,496 lít khí (đktc). M là
A. K.
B. Li.
C. Rb.
D. Na.
Câu 10. Hợp chất Ba(HCO3)2 tác dụng với dung dịch nào sau đây không sinh ra kết tủa?
A. Dung dịch Na2SO4.
B. Dung dịch NaOH.
C. Dung dịch Na2CO3.
D. Dung dịch HCl.
Câu 11. Phương pháp điện phân nóng chảy dùng để điều chế các kim loại
A. hoạt động trung bình như Fe, Zn.
B. hoạt động mạnh như Ca, Na.
C. mọi kim loại như Cu, Na, Fe, Al.
D. kém hoạt động như Ag, Au.
Câu 12. Hấp thụ hết 11,2 lít CO2 (ở đktc) vào dung dịch chỉ chứa 25,9 gam Ca(OH)2 thu được a gam chất rắn Y. Giá trị của a là
A. 15 gam.
B. 10 gam.
C. 20 gam.
D. 35 gam.
Câu 13. Chất vừa bị nhiệt phân vừa có tính lưỡng tính là
A. Al2O3.
B. CaCO3.
C. Na2CO3.
D. NaHCO3.
Câu 14. Khi điện phân dung dịch CuSO4 (điện cực trơ), tại anot (A) xảy ra
A. sự oxi hoá ion Cu2+ thành Cu.
B. sự oxi hoá H2O thành O2.
C. sự khử H2O thành O2.
D. sự khử ion Cu2+ thành Cu.
Câu 15. Tìm phát biểu sai?
A. Đa số các nguồn nước trong tự nhiên đều là nước cứng.
B. Tất cả các loại nước cứng đều có thể làm mềm bằng vôi vừa đủ.
C. Nước mềm là nước có chứa ít hoặc không chứa các ion: Ca2+, Mg2+.
D. Khi cho xà phòng vào nước cứng sẽ có kết tủa.
Câu 16. Cho 17,04 gam hỗn hợp X gồm: Ca, MgO, Na2O tác dụng hết với 360 ml dung dịch HCl 2M (vừa đủ) thu được dung dịch Y. Khối lượng (gam) NaCl có trong Y là
A. 4,68.
B. 8,775.
C. 15,21.
D. 14,04.
Câu 17. Cho luồng khí CO (dư) qua hỗn hợp X gồm: CuO, Fe2O3, Al2O3, MgO nung nóng đến phản ứng hoàn toàn thu được hỗn hợp rắn Y. Y gồm
A. Cu, Fe, Al, MgO.
B. Cu, Fe, Al2O3, MgO.
C. Cu, Fe2O3, Al2O3, MgO.
D. Cu, Fe, Al, Mg.
Câu 18. Nung hỗn hợp G gồm: 7,2 gam Mg và 4,8 gam S trong bình kín (không có không khí). Sau một thời gian thu được chất rắn X. Cho X vào dung dịch HCl dư thu được hỗn hợp khí Y và chất rắn Z. Đốt cháy hoàn toàn (bằng O2 dư) Y và Z sau đó cho toàn bộ sản phẩm cháy lội từ từ qua nước vôi trong dư nhận thấy khối lượng dung dịch đã thay đổi là
A. giảm đi 5,1 gam.
B. tăng lên 8,4 gam.
C. giảm đi 3,0 gam.
D. tăng lên 15 gam.
Câu 19. Thạch cao sống là tên gọi của chất nào sau đây?
A. 2CaSO4.H2O.
B. CaSO4.H2O.
C. CaSO4.2H2O.
D. CaSO4.
Câu 20. Cho m gam kim loại gồm Mg và Al vào 500 ml dung dịch chứa Cu(NO3)2 0,5M và AgNO3 1M, sau phản ứng hoàn toàn thu được (m + 57,8) gam 2 kim loại. Cho lượng kim loại vừa thu được tác dụng với HNO3 dư thu được 6,72 lít NO (đktc). Giá trị của m gần nhất với
A. 9.
B. 11.
C. 8.
D. 15.
Câu 21. Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 6,72.
D. 7,84.
Câu 22. Cho hỗn hợp rắn gồm Na2O, BaO, NaHCO3, Al2O3 và NH4Cl có cùng số mol vào nước dư. Kết thúc các phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan là
A. Na2CO3, NaCl và NaAlO2.
B. BaCl2, NaAlO2, NaOH.
C. NaCl va NaAlO2.
D. AlCl3, NaCl, BaCl.
Câu 23. Cho 0,46 gam kim loại kiềm M tác dụng hết với H2O, thu được 0,01 mol khí H2. Kim loại M là
A. Li.
B. K.
C. Na.
D. Rb.
Câu 24. Al2O3 không phản ứng với chất nào sau đây?
A. HCl.
B. H2.
C. Ca(OH)2.
D. NaOH.
Câu 25. Nguyên tố hóa học nào sau đây thuộc nhóm kim loại kiềm thổ
A. Natri.
B. Bari.
C. Nhôm.
D. Kali.
Câu 26. Cho 4,8 gam kim loại X tác dụng với HCl dư được 4,48 lít H2 (đktc). X là
A. Fe
B. Mg
C. Cu
D. Ca
Câu 27. Cho 6 gam một oxit kim loại hóa trị II tác dụng vừa đủ với HCl cho 14,25 gam muối clorua của kim loại đó. Cho biết công thức oxit kim loại?
A. CaO.
B. MgO.
C. CuO.
D. Al2O3.
Câu 28. Thí nghiệm nào sau đây tạo ra kết tủa sau khi kết thúc phản ứng?
A. Cho dung dịch Ba(OH)2 dư vào dung dịch AlCl3.
B. Cho dung dịch NH3 dư vào dung dịch AlCl3.
C. Cho Al vào dung dịch NaOH dư.
D. Đun nóng nước có tính cứng vĩnh cửu.
Câu 29. Trong các kim loại kiềm, kiềm thổ sau: Li, Cs, Ba, Be; kim loại có nhiệt độ nóng chảy thấp nhất là
A. Cs.
B. Li.
C. Ba.
D. Be.
Câu 30. Hỗn hợp X gồm a mol Al và b mol Na. Hỗn hợp Y gồm b mol Al và a mol Na. Thực hiện 2 thí nghiệm sau:
Thí nghiệm 1: Hòa tan hỗn hợp X vào nước dư thu được 5,376 lít khí H2, dung dịch X1 và m gam chất rắn không tan.
Thí nghiệm 2: Hòa tan hỗn hợp Y vào nước dư thu được dung dịch Y1 trong đó khối lượng NaOH là 1,2 gam. Biết thể tích khí đo ở đktc. Tổng khối lượng Al trong hỗn hợp X và Y là
A. 6,75 gam.
B. 7,02 gam.
C. 7,29 gam.
D. 7,56 gam.
Đề thi Giữa học kì 2 Hoá học lớp 12 năm 2022 có ma trận đề số 2
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Fe = 56; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Chọn thứ tự giảm dần độ hoạt động hoá học của các kim loại kiềm?
A. Na, K, Cs, Rb, Li.
B. Cs, Rb, K, Na, Li.
C. Li, Na, K, Rb, Cs.
D. K, Li, Na, Rb, Cs.
Câu 2. Cấu hình electron lớp ngoài cùng nào sau đây ứng với kim loại kiềm?
A. ns2np1.
B. ns1.
C. ns2np5.
D. ns2np2.
Câu 3. Chất nào dưới đây được sử dụng để nặn tượng, làm khuôn đúc, làm vật liệu xây dựng và bó chỉnh hình trong y học ?
A. CaSO4.2H2O.
B. MgSO4.7H2O.
C. CaSO4.
D. CaSO4.H2O.
Câu 4. Khi cho kim loại Mg vào dung dịch chứa đồng thời các muối: Cu(NO3)2, AgNO3, Fe(NO3)2 khuấy đều để các phản ứng xảy ra hoàn toàn, ta thu được chất rắn X gồm 2 kim loại. Hai kim loại đó là
A. Cu, Fe.
B. Fe, Ag.
C. Ag, Mg.
D. Cu, Ag.
Câu 5. Có 6 dung dịch riêng biệt: Fe(NO3)3, AgNO3, CuSO4, ZnCl2, Na2SO4, MgSO4. Nhúng vào mỗi dung dịch một thanh Cu kim loại, số trường hợp xảy ra ăn mòn điện hóa là
A. 3
B. 1
C. 4
D. 2
Câu 6. Cho 20,55 gam Ba vào lượng dư dung dịch MgSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Gía trị của m là
A. 3,60.
B. 34,95.
C. 8,70.
D. 43,65.
Câu 7. Cho bột Al từ từ đến dư vào các dung dịch riêng rẽ chứa các chất HCl, FeCl3, CuSO4; Ba(OH)2. Số lượng các phản ứng xảy ra là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 8. Criolit (Na3AlF6 hay 3NaF.AlF3) là nguyên liệu được dùng để sản xuất nhôm với mục đích:
1) Làm giảm nhiệt độ nóng chảy của Al2O3.
2) Tiết kiệm được năng lượng, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
3) Tạo chất lỏng có tỉ khối nhỏ hơn nhôm, nổi lên bề mặt nhôm ngăn cản nhôm nóng chảy bị oxi hoá.
A. 1, 2.
B. 2, 3.
C. 1, 3.
D. 1, 2, 3.
Câu 9. Cho 3 gam hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước. Để trung hoà dung dịch thu được cần 800 ml dung dịch HCl 0,25M. Kim loại M là
A. Li.
B. Cs.
C. K.
D. Rb.
Câu 10. Để chống ăn mòn cho đường ống dẫn dầu bằng thép chôn dưới đất, người ta dùng phương pháp điện hoá. Trong thực tế, người ta dùng kim loại nào sau đây làm điện cực hi sinh?
A. Zn.
B. Sn.
C. Cu.
D. Na.
Câu 11. Cho 4,48 lít CO2 hấp thụ hết vào 100 ml dung dịch hỗn hợp gồm NaOH 0,6M và Ba(OH)2 1,2M sinh ra kết tủa và dung dịch X. Cô cạn dung dịch X thu được m gam muối. Giá trị của m là
A. 5,18.
B. 5,04.
C. 7,12.
D. 10,22.
Câu 12. Khi điện phân nóng chảy MgCl2 thì
A. ion Mg2+ bị oxi hoá ở cực dương.
B. ion Mg2+ bị khử ở cực âm.
C. nguyên tử Mg bị oxi hoá ở cực dương.
D. ion Mg2+ bị oxi hoá ở cực âm.
Câu 13. Kim loại không phản ứng với nước ở nhiệt độ thường là
A. Be, Sr.
B. Be, Mg.
C. Li, Ca.
D. Cs, Sr.
Câu 14. Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. kết tủa trắng sau đó tan dần.
B. bọt khí và kết tủa trắng.
C. bọt khí bay ra.
D. kết tủa trắng xuất hiện.
Câu 15. Oxit nhôm không phản ứng với chất nào sau đây?
A. HCl.
B. H2.
C. Ca(OH)2.
D. NaOH.
Câu 16. Dùng phương pháp nào để điều chế kim loại nhóm IIA?
A. Điện phân nóng chảy.
B. Điện phân dung dịch.
C. Nhiệt luyện.
D. Thuỷ luyện.
Câu 17. Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là
A. NaOH, CO2, H2.
B. Na2O, CO2, H2O.
C. Na2CO3, CO2, H2O.
D. NaOH, CO2, H2O.
Câu 18. Trong quá trình điện phân dung dịch NaCl, ở cực âm xảy ra quá trình gì?
A. Sự khử ion Na+.
B. Sự oxi hoá ion Na+.
C. Sự khử phân tử nước.
D. Sự oxi hoá phân tử nước.
Câu 19. Hòa tan hết 0,54 gam Al trong 70ml dung dịch HCl 1M thu được dung dịch X. Cho 75ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 1,56.
B. 1,17.
C. 0,39
D. 0,78.
Câu 20. Đốt cháy 2,15 gam hỗn hợp gồm Zn, Al và Mg trong khí oxi dư, thu được 3,43 gam hỗn hợp X. Toàn bộ X phản ứng vừa đủ với V ml dung dịch HCl 0,5M. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 160.
B. 240.
C. 480.
D. 320.
Câu 21. Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là
A. Mg và Zn.
B. Na và Cu.
C. Ca và Fe.
D. Fe và Cu.
Câu 22. Nung hỗn hợp gồm 0,08 mol Al và 0,03 mol Fe3O4 một thời gian thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 2,24 lít khí H2 (đktc) và m gam muối. Giá trị của m gần giá trị nào nhất sau đây
A. 21 gam.
B. 22 gam.
C. 23 gam.
D. 20 gam.
Câu 23. Phát biểu nào sau đây không đúng
A. Nguyên tắc làm mềm nước cứng là làm giảm nồng độ ion Ca2+, Mg2+.
B. Có thể điều chế nhôm bằng cách dùng khí CO khử Al2O3 ở nhiệt độ cao.
C. Dung dịch HCl không làm mềm được nước cứng tạm thời.
D. Trong các hợp chất, nguyên tố kim loại kiềm thổ chỉ có số oxi hóa là +2.
Câu 24. Cho 10 gam hỗn hợp X gồm KHCO3 và CaCO3 và dung dịch HCl dư, thu được thể tích khí (đktc)
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Câu 25. Cho 7,26 gam hỗn hợp gồm Mg và Al vào 200 ml dung dịch Fe(NO3)3 0,6M và Cu(NO3)2 1M. sau khi kết thúc phản ứng thu được dung dịch X và 17,28 gam rắn Y. Cho dung dịch NaOH dư vào dung dịch X, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam rắn khan. Giá trị m là
A. 14,0 gam.
B. 15,1 gam.
C. 15,9 gam.
D. 10,8 gam.
Câu 26. Điện phân 500 ml dung dịch AlCl3 0,3M trong thời gian 5790 giây với dòng điện một chiều cường độ I = 2A. Các phản ứng hoàn toàn. Khối lượng dung dịch sau điện phân giảm so với ban đầu là
A. 4,38.
B. 7,50.
C. 5,22.
D. 6,82.
Câu 27. Cho các quá trình sau:
1) Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
2) Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
3) Cho dung dịch HCl dư vào dung dịch NaAlO2.
4) Dẫn khí CO2 dư vào dung dịch NaAlO2.
5) Cho dung dịch AlCl3 dư vào dung dịch NaAlO2.
6) Cho dung dịch NH4Cl dư vào dung dịch NaAlO2.
Số quá trình không thu được kết tủa là
A. 0.
B. 2.
C. 1.
D. 3.
Câu 28. Cho các chất: NaHCO3, CO, Al(OH)3, Fe(OH)3, HF, Cl2, NH4Cl. Số chất tác dụng được với dung dịch NaOH loãng ở nhiệt độ thường là
A. 4.
B. 5.
C. 3.
D. 6.
Câu 29. Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 6,72.
D. 7,84.
Câu 30. Cho 100 ml dung dịch NaOH 3M tác dụng với 100 ml dung dịch AlCl3 2M. Kết thúc phản ứng, thu được m gam kết tủa. Giá trị của m là
A. 23,4.
B. 7,8.
C. 15,6.
D. 3,9.
Đề thi Giữa học kì 2 Hoá học lớp 12 năm 2022 có ma trận đề số 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Fe = 56; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Cho các cặp kim loại tiếp xúc trực tiếp Fe - Pb, Fe - Zn, Fe - Sn, Fe - Ni, Fe - Cu, nhúng từng cặp kim loại vào dung dịch axit loãng. Số cặp kim loại mà Fe bị ăn mòn trước là
A. 3.
B. 4.
C. 1.
D. 2.
Câu 2. Phản ứng nào sau đây giải thích sự xâm thực của nước mưa đối với đá vôi?
A. CaCO3 + CO2 + H2O → Ca(HCO3)2.
B. CaCO3 → CaO + CO2.
C. CaO + CO2 → CaCO3.
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Câu 3. Cho luồng khí CO dư và H2 dư đi qua m gam hỗn hợp X gồm CuO, Fe2O3 đun nóng. Sau phản ứng hoàn toàn thấy khối lượng rắn giảm 4,8 gam. Thể tích dung dịch H2SO4 2M tối thiểu hòa tan hết m gam hỗn hợp X là
A. 150 ml.
B. 200 ml.
C. 100 ml.
D. 250 ml.
Câu 4. Nhận định đúng là
A. Có thể dùng vôi bột (CaO) để làm khô khí SO2.
B. Cô cạn nước cứng tạm thời thu được rắn khan Ca(HCO3)2; Mg(HCO3)2.
C. Thạch cao khan có công thức là CaSO4.
D. Điện phân NaCl nóng chảy và điện phân dung dịch NaCl thì quá trình khử giống nhau.
Câu 5. Tiến hành 3 thí nghiệm như hình vẽ sau:
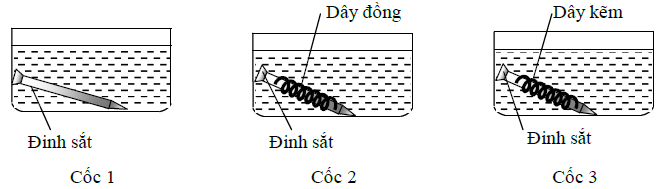 Đinh sắt trong cốc nào sau đây bị ăn mòn nhanh nhất
Đinh sắt trong cốc nào sau đây bị ăn mòn nhanh nhất
A. Cốc 2.
B. Cốc 1.
C. Cốc 3.
D. Tốc độ như nhau.
Câu 6. Để sản xuất nhôm trong công nghiệp người ta thường:
A. Điện phân dung dịch AlCl3.
B. Cho Mg vào dung dịch Al2(SO4)3.
C. Cho CO dư đi qua Al2O3 nung nóng.
D. Điện phân Al2O3 nóng chảy có mặt criolit.
Câu 7. Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Thạch cao nung (CaSO4.H2O).
B. Đá vôi (CaCO3).
C. Vôi sống (CaO).
D. Thạch cao sống (CaSO4.2H2O).
Câu 8. Nước cứng là nước có đặc điểm nào sau đây?
A. Chứa nhiều ion Ca2+, Mg2+.
B. Chứa 1 lượng cho phép Ca2+, Mg2+.
C. Không chứa Ca2+, Mg2+.
D. Chứa nhiều Ca2+, Mg2+, HCO3-.
Câu 9. Nung nóng hỗn hợp gồm Al và Fe3O4 (tỉ lệ mol 1 : 1) trong điều kiện không có không khí, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Giả sử chỉ có phản ứng chuyển Fe3O4 về Fe. Rắn X chứa?
A. Al2O3 và Fe.
B. Al2O3, Fe3O4, Fe.
C. Al2O3, Al, Fe.
D. Al2O3, Fe3O4, Al, Fe.
Câu 10. Điều khẳng định nào sau đây là sai?
A. Nhôm là kim loại nhẹ, có tính khử mạnh và là kim loại phổ biến trong vỏ trái đất.
B. Natri và kali được dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân.
C. Phèn chua có công thức là NaAl(SO4)2.12H2O.
D. Nhôm được điều chế bằng cách điện phân nóng chảy Al2O3.
Câu 11. Cho 200 ml dung dịch Al2(SO4)3 0,5M tác dụng với 200 gam dung dịch NaOH thu được 11,7 gam kết tủa trắng. Nồng độ dung dịch NaOH đã dùng là
A. 9%.
B. 12%.
C. 13%.
D. Phương án khác.
Câu 12. Phản ứng hoá học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe3O4 nung nóng.
B. Al tác dụng với axit H2SO4 đặc, nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với CuO nung nóng.
Câu 13. Sục khí CO2 tới dư vào dung dịch nào sau đây luôn thu được kết tủa?
A. NaOH.
B. NaAlO2.
C. Ca(OH)2.
D. BaCl2.
Câu 14. Cho dãy các kim loại: Na, Cu, Mg, Ca, Fe, Be, Ba, K, Ag. Số kim loại trong dãy tác dụng với nước ở điều kiện thường tạo thành dung dịch bazơ là
A. 5.
B. 6.
C. 7.
D. 4.
Câu 15. Nếu vật làm bằng hợp kim Fe - Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn
A. sắt đóng vai trò anot và bị oxi hoá.
B. kẽm đóng vai trò anot và bị oxi hoá.
C. sắt đóng vai trò catot và ion H+ bị oxi hóa.
D. kẽm đóng vai trò catot và bị oxi hóa.
Câu 16. Cho 1,05 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khi H2 (ở đktc). Hai kim loại đó là
A. Be và Mg.
B. Mg và Ca.
C. Sr và Ba.
D. Ca và Sr.
Câu 17. Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hoà tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 27,96.
B. 29,52.
C. 36,51.
D. 1,50.
Câu 18. Hòa tan m (g) hỗn hợp X gồm Al và Na có tỉ lệ mol 1 : 2 vào nước dư thu được 4,48 (l) khí (đktc). Gíá trị của m là
A. 7,3.
B. 5,84.
C. 6,15.
D. 3,65.
Câu 19. Cho 0,10 mol Ba vào dung dịch chứa 0,15 mol CuSO4 và 0,12 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, lọc lấy kết tủa nung ở nhiệt độ cao đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là
A. 25,2 gam.
B. 26,5 gam.
C. 24,9 gam.
D. 23,3 gam.
Câu 20. Cho các chất sau: Al; NH2C2H4COOH; NaHCO3; AlCl3; SO2; Al(OH)3. Có bao nhiều chất lưỡng tính trong dãy trên là
A. 3.
B. 5.
C. 4.
D. 2.
Câu 21. Chất nào sau đây là chất lưỡng tính?
A. Al.
B Al2O3.
C. AlCl3.
D NaOH.
Câu 22. Hoà tan 2,3 gam kim loại R vào nước, sau phản ứng thu được 1,12 lít H2 (đktc). Kim loại R là
A. Li.
B. Na.
C. K.
D. Ba.
Câu 23. Phát biểu nào sau đây sai?
A. Dung dịch NaHCO3 trong nước có phản ứng kiềm mạnh.
B. Kim loại kiềm có nhiệt độ nóng chảy, nhiệt độ sôi thấp.
C. Kim loại Cs dùng để chế tạo tế bào quang điện.
D. Kim loại kiềm có tính khử mạnh nhất trong số các kim loại.
Câu 24. Trong các kim loại Na, Fe, Cu, Ag, Al. Có bao nhiêu kim loại chỉ điều chế được bằng phương pháp điện phân?
A. 1.
B. 2.
C. 4.
D. 3.
Câu 25. Hỗn hợp gồm 1,3 mol Mg và x mol Zn vào dung dịch chứa 2 mol Cu2+ và 2 mol Ag+ sau phản ứng hoàn toàn, lọc bỏ phần dung dịch thu được chất rắn gồm 2 kim loại. Giá trị của x có thể là
A. 1,8.
B. 2.
C. 2,2.
D. 1,5.
Câu 26. Cho 10 mL dung dịch hỗn hợp HNO3 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa 10 mL dung dịch hỗn hợp các axit trên là
A. 0,02 lít.
B. 0,01 lít.
C. 0,05 lít.
D. 0,04 lít.
Câu 27. Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Câu 28. Chia m gam hỗn hợp Na2O và Al2O3 thành 2 phần bằng nhau:
- Phần 1: Hoà tan trong nước dư thu được 1,02 gam chất rắn không tan.
- Phần 2: Hoà tan vừa hết trong 140 ml dung dịch HCl 1M.
Giá trị của m là
A. 2,26.
B. 2,66.
C. 5,32.
D. 7,00.
Câu 29. Hòa tan hết rắn X gồm Al và Al2O3 có tỉ lệ mol tương ứng 2 : 1 trong dung dịch H2SO4 loãng dư, thu được 2,688 lít khí H2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được lượng rắn khan là
A. 47,20 gam.
B. 27,36 gam.
C. 25,20 gam.
D. 31,68 gam.
Câu 30. Kim loại có những tính chất vật lý chung nào sau đây?
A. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn, có ánh kim.
B. Tính dẻo, có ánh kim, tính cứng.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
D. Tính dẻo, tính dẫn nhiệt, nhiệt độ nóng chảy cao.
Xem thêm các chương trình khác:
- Giải sgk Hóa học 12
- Lý thuyết Hóa học 12
- Giải sbt Hóa học 12
- Các dạng bài tập Hoá học lớp 12
- Giáo án Hóa học lớp 12 mới nhất
- Giải sgk Toán 12
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Góp ý sgk lớp 12 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi chính thức các môn THPT Quốc Gia các năm
- (3000+) Đề thi thử THPT Quốc Gia (các năm) từ các trường, sở trên cả nước
- Đề minh họa THPT quốc gia các năm
- Đề thi Đánh giá năng lực năm 2023 | Thông tin | Cấu trúc ĐGNL ĐHQG Hà Nội, HCM, ĐHBK, Bộ Công an
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
