Câu hỏi:
13/07/2024 96
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Trả lời:
a) Công thức Lewis của Cl2 là:
Bước 1. Số electron hóa trị là 2.7 = 14 electron
Bước 2. Trong phân tử Cl2, mỗi nguyên tử Cl cần 1 electron để đạt octet.
Cl – Cl
Bước 3. Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet:
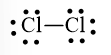
Bước 4. Số electron hóa trị còn lại là: 14 – 6.2 – 2.1 = 0
Cả hai nguyên tử Cl đều đạt octet nên công thức Lewis của Cl2 là:
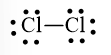
Công thức Lewis của N2 là:
Bước 1. Số electron hóa trị là 5.2 = 10 electron
Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
N – N
Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
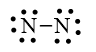
Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
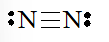
b) Công thức Lewis của SO2 là:
Số electron hóa trị là 1.6 + 2.6 = 18 electron.
Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh: O – S – O.
Hoàn thiện octet cho nguyên tử O:
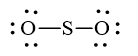
Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
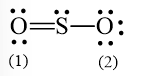
Công thức Lewis của SO3 là:
- Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
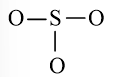
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
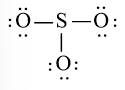
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
chung.
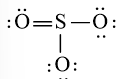 hoặc
hoặc 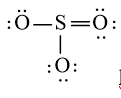 hoặc
hoặc 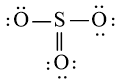
c) Công thức Lewis của H2O là:
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh. H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
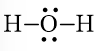
Công thức Lewis của H2S là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh: H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
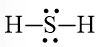
Công thức Lewis của HOCl là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quang: H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 7 electron hóa trị để đạt octet:
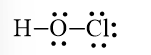
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Câu 2:
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Câu 3:
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Câu 5:
Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2.
b) Phân tử SO2.
c) Phân tử NH3.
Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2.
b) Phân tử SO2.
c) Phân tử NH3.
Câu 6:
Vận dụng công thức phân tử theo mô hình VSEPR đề dự đoán dạng hình học và vận dụng khái niệm lai hoá orbital để giải thích dạng hình học đã dự đoán theo công thức phân tử theo mô hình VSEPR.
Vận dụng công thức phân tử theo mô hình VSEPR đề dự đoán dạng hình học và vận dụng khái niệm lai hoá orbital để giải thích dạng hình học đã dự đoán theo công thức phân tử theo mô hình VSEPR.
Câu 9:
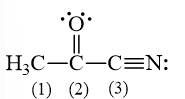
Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hóa nào?
Câu 11:
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực, … của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử?
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực, … của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử?
Câu 13:
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.


