Câu hỏi:
13/07/2024 121
Công thức Lewis của CS2 là
Công thức Lewis của CS2 là
A. 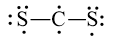
B.
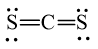
C.
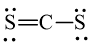
D. S = C = S
D. S = C = S
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Trả lời:
Đáp án đúng là: B
Tổng số electron hóa trị = 1.4 + 2.6 = 16 electron.
Trong phân tử CS2, nguyên tử C cần 4 electron để đạt octet, nguyên tử S cần 2 electron hóa trị để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử S được xếp quanh: S – C – S.
Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet:
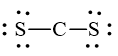
Số electron hóa trị còn lại = 16 – 2.2 – 2.6 = 0
Số electron hóa trị của nguyên tử C là 4 nên đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử C.
Công thức Lewis của CS2 là
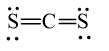
Trả lời:
Đáp án đúng là: B
Tổng số electron hóa trị = 1.4 + 2.6 = 16 electron.
Trong phân tử CS2, nguyên tử C cần 4 electron để đạt octet, nguyên tử S cần 2 electron hóa trị để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử S được xếp quanh: S – C – S.
Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet:
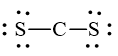
Số electron hóa trị còn lại = 16 – 2.2 – 2.6 = 0
Số electron hóa trị của nguyên tử C là 4 nên đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử C.
Công thức Lewis của CS2 là
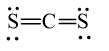
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Câu 2:
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Câu 3:
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Câu 5:
Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2.
b) Phân tử SO2.
c) Phân tử NH3.
Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2.
b) Phân tử SO2.
c) Phân tử NH3.
Câu 6:
Vận dụng công thức phân tử theo mô hình VSEPR đề dự đoán dạng hình học và vận dụng khái niệm lai hoá orbital để giải thích dạng hình học đã dự đoán theo công thức phân tử theo mô hình VSEPR.
Vận dụng công thức phân tử theo mô hình VSEPR đề dự đoán dạng hình học và vận dụng khái niệm lai hoá orbital để giải thích dạng hình học đã dự đoán theo công thức phân tử theo mô hình VSEPR.
Câu 8:
Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hóa nào?
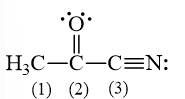
Câu 10:
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực, … của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử?
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực, … của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử?
Câu 11:
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Câu 13:
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.


