Câu hỏi:
13/07/2024 88
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?

Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?

Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị.
Vậy liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị.
Vậy liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2).
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2).
Câu 2:
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
Hydrogen halide
Năng lượng liên kết (kJ/mol)
HF
565
HCl
427
HBr
363
HI
295
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
|
Hydrogen halide |
Năng lượng liên kết (kJ/mol) |
|
HF |
565 |
|
HCl |
427 |
|
HBr |
363 |
|
HI |
295 |
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Câu 3:
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Câu 5:
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Câu 6:
Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon hình thành liên kết đôi trong phân tử ethylene (C2H4).
Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon hình thành liên kết đôi trong phân tử ethylene (C2H4).
Câu 9:
Nitrogen chiếm khoảng 78% thể tích không khí nhưng chỉ hoạt động ở nhiệt độ cao. Vì sao nitrogen là một chất khí không hoạt động ở điều kiện thường?
Nitrogen chiếm khoảng 78% thể tích không khí nhưng chỉ hoạt động ở nhiệt độ cao. Vì sao nitrogen là một chất khí không hoạt động ở điều kiện thường?
Câu 10:
Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Câu 11:
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2.
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2.
Câu 13:
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Câu 14:
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết π? Cho ví dụ.
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết π? Cho ví dụ.
Câu 15:
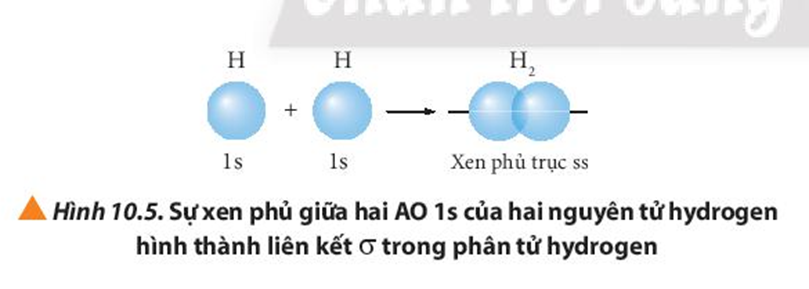
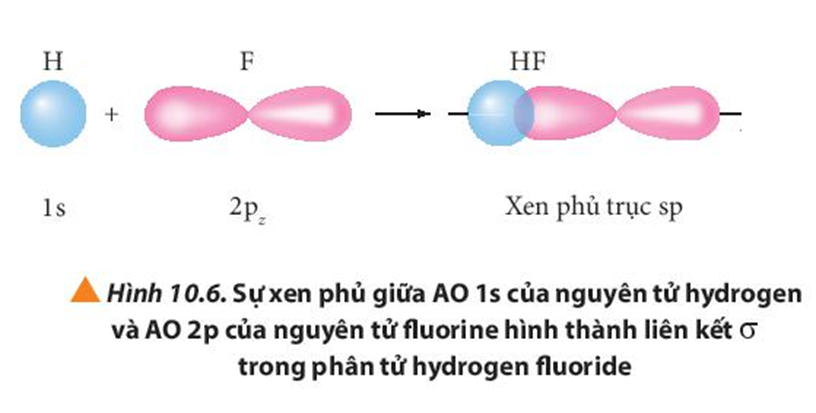
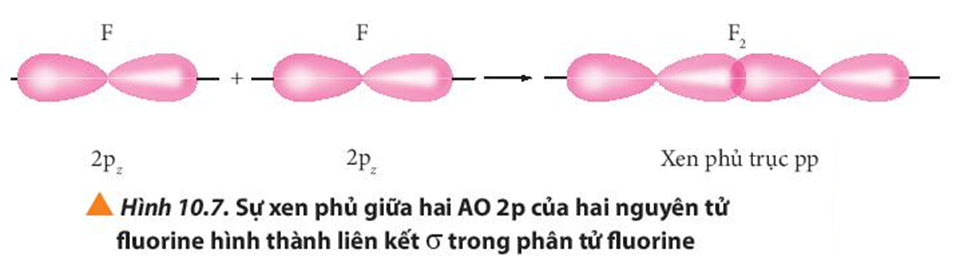
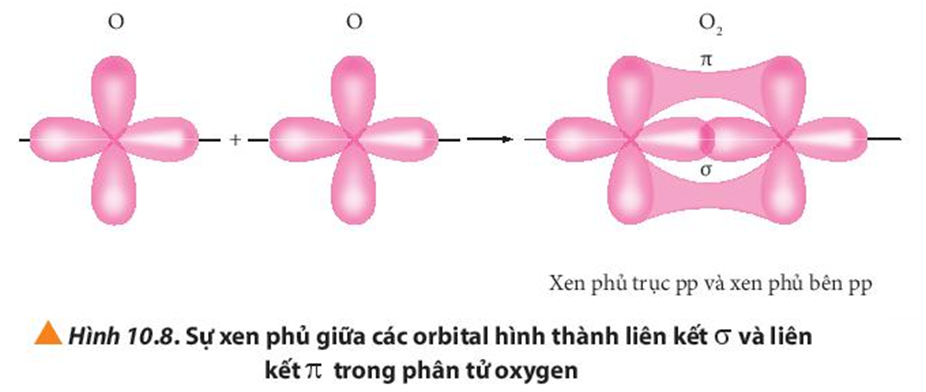
Quan sát các Hình từ 10.5 đến 10.8, cho biết liên kết nào trong mỗi phân tử được tạo thành bởi sự xen phủ trục hoặc xen phủ bên của các orbital.