Câu hỏi:
22/07/2024 507
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2.
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
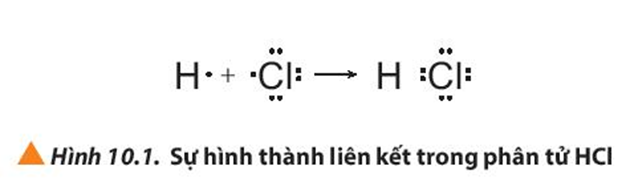
- Xét phân tử HCl:
+ Nguyên tử hydrogen (H) có cấu hình electron là 1s1, chlorine (Cl) có cấu hình electron là [Ne]3s23p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron dùng chung cho cả hai nguyên tử. Lên kết giữa H và Cl được tạo nên bởi 1 cặp electron dùng chung
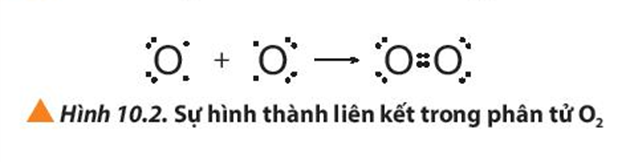
+ Nguyên tử oxygen (O) có cấu hình electron là 1s22s22p4 . Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử O đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử O cùng góp 2 electron để tạo nên 2 cặp electron dùng chung cho cả hai nguyên tử.
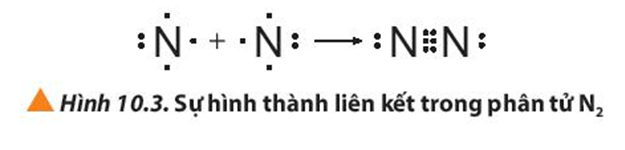
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2).
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2).
Câu 2:
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
Hydrogen halide
Năng lượng liên kết (kJ/mol)
HF
565
HCl
427
HBr
363
HI
295
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
|
Hydrogen halide |
Năng lượng liên kết (kJ/mol) |
|
HF |
565 |
|
HCl |
427 |
|
HBr |
363 |
|
HI |
295 |
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Câu 3:
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Câu 5:
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4.
Câu 6:
Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon hình thành liên kết đôi trong phân tử ethylene (C2H4).
Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon hình thành liên kết đôi trong phân tử ethylene (C2H4).
Câu 9:
Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Câu 10:
Nitrogen chiếm khoảng 78% thể tích không khí nhưng chỉ hoạt động ở nhiệt độ cao. Vì sao nitrogen là một chất khí không hoạt động ở điều kiện thường?
Nitrogen chiếm khoảng 78% thể tích không khí nhưng chỉ hoạt động ở nhiệt độ cao. Vì sao nitrogen là một chất khí không hoạt động ở điều kiện thường?
Câu 11:
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO.
Câu 13:
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết π? Cho ví dụ.
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết π? Cho ví dụ.
Câu 14:
Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3.
Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3.