Trắc nghiệm Hóa học 9 Bài 18: Nhôm
-
269 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
22/07/2024Nhôm có tính chất vật lí là
 Xem đáp án
Xem đáp án
Đáp án A
Nhôm có màu trắng bạc, nhẹ, có ánh kim, dẫn điện và dẫn nhiệt tốt.
Câu 2:
11/07/2024Quặng boxit là nguyên liệu chính dùng để điều chế kim loại
 Xem đáp án
Xem đáp án
Đáp án A
Quặng boxit là nguyên liệu chính dùng để điều chế kim loại Al.
Câu 3:
18/07/2024Nhôm không phản ứng được với dung dịch
 Xem đáp án
Xem đáp án
Đáp án B
Nhôm không phản ứng được với dung dịch HNO3 đặc, nguội.
Câu 4:
20/07/2024Các đồ vật bằng nhôm bền trong không khí và nước do
 Xem đáp án
Xem đáp án
Đáp án B
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng, bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
Câu 5:
22/07/2024Cách nào sau đây không phá hủy các đồ dùng làm bằng nhôm
 Xem đáp án
Xem đáp án
Đáp án B
Rửa sạch, lau khô và để chỗ khô ráo sau khi sử dụng sẽ giúp các đồ vật bằng nhôm tránh bị oxi hóa.
Câu 6:
22/07/2024Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được khí H2 (ở đktc). Thể tích khí H2 là
 Xem đáp án
Xem đáp án
Đáp án B
nAl = 0,2 mol
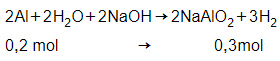
→VH2 = 0,3.22,4 = 6,72 lít
Câu 7:
20/07/2024Cho 2,04 gam oxit của một kim loại có công thức là M2O3 tác dụng vừa đủ 600mL dung dịch HCl 0,2M. Công thức oxit đó là
 Xem đáp án
Xem đáp án
Đáp án B
nHCl = 0,2.0,6 = 0,12 mol
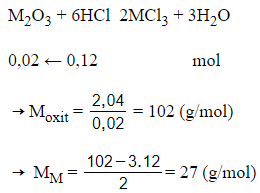
Vậy kim loại là Al, oxit kim loại là Al2O3.
Câu 8:
22/07/2024Cho 10,8 gam một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4 gam muối. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án C
Phương trình hóa học:
2M + 3Cl2 → 2MCl3
Áp dụng định luật bảo toàn khối lượng:
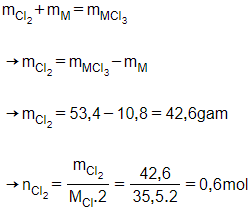
Theo phương trình:
nM2=nCl23=0,63=0,2
→nM = 0,2.2 = 0,4 mol
MM=mMnM=10,80,4=27
M là nhôm (Al)
Câu 9:
20/07/2024Hòa tan 9,72 gam Al bằng dung dịch H2SO4 loãng thu được V lit khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
nAl=mAlMAl=9,7227=0,36mol
Phương trình hóa học:
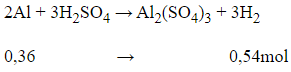
Thể tích khí hiđro sinh ra là
V = 0,54.22,4 =12,096 lít
Câu 10:
14/07/2024Phần trăm theo khối lượng của Al có trong Al2O3.2SiO2.2H2O là
 Xem đáp án
Xem đáp án
Đáp án D

Câu 11:
13/07/2024Cho 5,4 gam Al vào 100 mL dung dịch H2SO4 0,5M. Giả sử thể tích dung dịch thay đổi không đáng kể. Thể tích khí H2 sinh ra (ở đktc) là
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình hóa học:
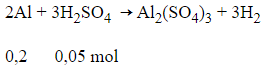
Ta có: nAl2>nH2SO43
→ Al dư, số mol H2 sinh ra tính theo số mol H2SO4.
Theo phương trình hóa học:
nH2=nH2SO4=0,05mol
VHidro = 0,05.22,4=1,12 lít
Câu 12:
21/07/2024Oxi hóa hoàn toàn 8,1 gam nhôm cần vừa đủ V lít khí clo (đktc). Giá tri của V là
 Xem đáp án
Xem đáp án
Đáp án A
nAl=mAlMAl= 0,3 mol
Phương trình hóa học:
2Al + 3Cl2 → 2AlCl3
0,3 → 0,45 mol
Thể tích khí clo cần dùng là:
V = 0,45. 22,4 = 10,08 lít.
Câu 13:
23/07/2024Cho sơ đồ phản ứng: Al + Cl2 →….
Tổng hệ số (là các số nguyên, tối giản) của phương trình là:
 Xem đáp án
Xem đáp án
Đáp án B
2Al + 3Cl2 t°→2AlCl3
Tổng hệ số tối giản: 2 + 3 + 2 = 7
Câu 14:
19/07/2024Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án B
nH2=V22,4=0,15mol
Phương trình hóa học:
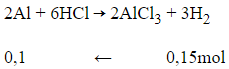
Theo phương trình:
nAl = 0,1 mol
mAl= 0,1. 27 = 2,7 gam
Câu 15:
18/07/2024Cho 1,35g Al vào dung dịch chứa 7,3g HCl. Khối lượng muối nhôm tạo thành là
 Xem đáp án
Xem đáp án
Đáp án A
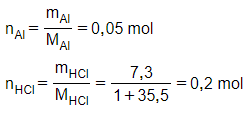
Phương trình hóa học:
2Al + 6HCl 2AlCl3 + 3H2
Ta có: nHCl6>nAl2 → sau phản ứng HCl dư, số mol AlCl3 tính theo số mol Al.
Theo PTHH có:
nAlCl3=nAl=0,05 mol⇒mAlCl3=0,05.133,5=6,675g
