Giải SGK Hóa 11 CTST Bài 3. Đơn chất nitrogen
Giải SGK Hóa 11 CTST Bài 3. Đơn chất nitrogen
-
128 lượt thi
-
14 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
13/07/2024Nitrogen là khí có hàm lượng lớn nhất trong không khí, có vai trò cung cấp đạm tự nhiên cho cây trồng. Nitrogen có tính chất gì và có những ứng dụng nào trong cuộc sống?

 Xem đáp án
Xem đáp án
- Tính chất vật lí của nitrogen: Ở điều kiện thường, nitrogen là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hoá lỏng ở -196 oC và hoá rắn ở -210 oC. Khí nitrogen ít tan trong nước.
- Tính chất hoá học của khí nitrogen:
+ Tác dụng với hydrogen ở nhiệt độ cao, áp suất cao, có xúc tác tạo khí ammonia:
N2(g) + 3H2(g) 2NH3(g)
+ Tác dụng với oxygen ở khoảng 3 000 oC tạo thành nitrogen monoxide:
- Một số ứng dụng của khí nitrogen:
+ Trong sản xuất rượu, bia khí nitrogen được bơm vào các bể chứa để loại bỏ khí oxygen.
+ Trong công nghệ đóng gói thực phẩm, khí nitrogen được bơm vào túi để loại bỏ khí oxygen và làm phồng bao bì.
+ Trong chữa cháy, nitrogen được dùng để dập tắt các đám cháy do hoá chất, chập điện…
+ Trong lĩnh vực y tế, nitrogen lỏng được dùng để bảo quản máu, tế bào, dịch cơ thể, trứng, tinh trùng …
+ Trong khai thác dầu khí, hỗn hợp chứa N2 và CO2 được bơm vào bể chứa dầu mỏ để tạo áp suất đẩy dầu dư bị kẹt lại lên trên nhờ đặc tính nén cao.
Câu 2:
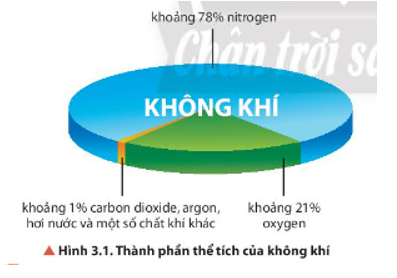
15/07/2024Quan sát Hình 3.1, cho biết trong không khí, khí nào chiếm tỉ lệ thể tích lớn nhất.
 Xem đáp án
Xem đáp án
Trong không khí, khí nitrogen chiếm tỉ lệ lớn nhất khoảng 78%.
Câu 3:
23/07/2024Ngoài đơn chất nitrogen thì nguyên tố nitrogen còn tồn tại dưới dạng nào? Lấy ví dụ.
 Xem đáp án
Xem đáp án
Ngoài đơn chất nitrogen thì nguyên tố nitrogen còn tồn tại ở dạng hợp chất. Nitrogen có nhiều trong các khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri. Nitrogen có trong thành phần của protein, nucleic acid, … và nhiều hợp chất hữu cơ khác.
Câu 4:
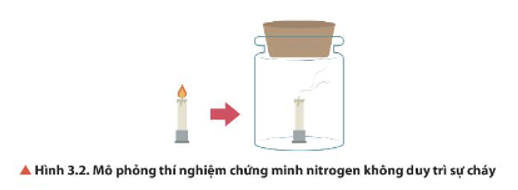
13/07/2024Quan sát Hình 3.2, nêu hiện tượng xảy ra. Giải thích.
 Xem đáp án
Xem đáp án
Hiện tượng: Cây nến đang cháy ngoài không khí bị tắt khi đưa vào bình chứa khí nitrogen.
Giải thích: Khí nitrogen không duy trì sự cháy.
Câu 5:
18/07/2024Nitrogen nặng hơn hay nhẹ hơn không khí? Tại sao?
 Xem đáp án
Xem đáp án
Khí nitrogen nhẹ hơn không khí do
Câu 6:
23/07/2024 Xem đáp án
Xem đáp án
Người ta có thể thu khí nitrogen trong phòng thí nghiệm bằng phương pháp đẩy nước do khí nitrogen tan rất ít trong nước (ở điều kiện thường, 1 lít nước hoà tan được 0,015 lít khí nitrogen).
Câu 7:
18/07/2024Quan sát Hình 3.3 và từ dữ kiện năng lượng liên kết trong phân tử N2, dự đoán về độ bền phân tử và khả năng phản ứng của nitrogen ở nhiệt độ thường.

 Xem đáp án
Xem đáp án
Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/mol) nên rất khó bị phá vỡ. Do đó, ở nhiệt độ thường phân tử nitrogen rất bền, khá trơ về mặt hoá học.
Câu 8:
20/07/2024Xác định tính oxi hoá, tính khử của nitrogen trong phản ứng của N2 với H2 và O2. Cho biết các phản ứng này thu nhiệt hay toả nhiệt.
 Xem đáp án
Xem đáp án
+ Phản ứng của N2 với H2:
N2(g) + 3H2(g) 2NH3(g)
Đây là phản ứng toả nhiệt do < 0.
Trong phản ứng này N2 đóng vai trò là chất oxi hoá, do số oxi hoá của nitrogen giảm từ 0 xuống -3.
+ Phản ứng của N2 với O2:
N2(g) + O2(g) 2NO(g)
Đây là phản ứng thu nhiệt do > 0.
Trong phản ứng này N2 đóng vai trò là chất khử, do số oxi hoá của nitrogen tăng từ 0 lên +2.
Câu 9:
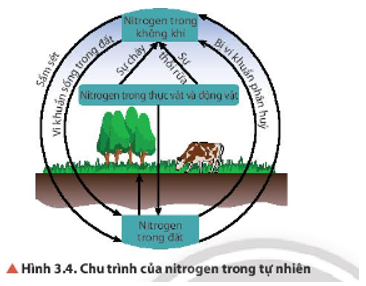
17/07/2024Quan sát Hình 3.4, cho biết con người có thể can thiệp vào chu trình của nitrogen trong tự nhiên bằng cách nào. Nếu sự can thiệp đó vượt ngưỡng cho phép thì ảnh hưởng gì đến môi trường?
 Xem đáp án
Xem đáp án
Ngày nay con người can thiệp vào chu trình nitrogen bằng cách bón phân đạm vào đất.
Kết quả của việc sử dụng phân đạm là tăng năng suất cây trồng tuy nhiên nó cũng đem lại hậu quả là ô nhiễm nguồn nước, đất …
Câu 10:
13/07/2024Quan sát Hình 3.5 và dựa vào các tính chất của nitrogen, hãy giải thích vì sao nitrogen có những ứng dụng đó.


 Xem đáp án
Xem đáp án
Ứng dụng của khí nitrogen:
+ Trong sản xuất rượu, bia khí nitrogen được bơm vào các bể chứa để loại bỏ khí oxygen.
+ Trong công nghệ đóng gói thực phẩm, khí nitrogen được bơm vào túi để loại bỏ khí oxygen và làm phồng bao bì.
+ Trong chữa cháy, nitrogen được dùng để dập tắt các đám cháy do hoá chất, chập điện…
+ Trong lĩnh vực y tế, nitrogen lỏng được dùng để bảo quản máu, tế bào, dịch cơ thể, trứng, tinh trùng …
+ Trong khai thác dầu khí, hỗn hợp chứa N2 và CO2 được bơm vào bể chứa dầu mỏ để tạo áp suất đẩy dầu dư bị kẹt lại lên trên nhờ đặc tính nén cao.
Các ứng dụng của khí nitrogen dựa vào tính trơ của nó.
Câu 11:
20/07/2024Giải thích vì sao người ta bơm khí nitrogen vào những lọ vaccine.
 Xem đáp án
Xem đáp án
Người ta bơm khí nitrogen vào những lọ vaccine để loại bỏ không khí, làm chậm quá trình hư hỏng của vaccine.
Câu 12:
22/07/2024Trình bày cấu tạo của phân tử N2. Giải thích vì sao ở điều kiện thường, N2 khá trơ về mặt hoá học.
 Xem đáp án
Xem đáp án
Phân tử N2 có công thức cấu tạo: N ≡ N.
Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/mol) nên rất khó bị phá vỡ. Do đó, ở nhiệt độ thường phân tử nitrogen rất bền, khá trơ về mặt hoá học.
Câu 13:
15/07/2024Viết phương trình hoá học chứng minh tính oxi hoá và tính khử của nitrogen. Cho biết số oxi hoá của nitrogen thay đổi như thế nào trong các phản ứng hoá học đó.
 Xem đáp án
Xem đáp án
- Phương trình hoá học chứng minh nitrogen có tính oxi hoá:
N2(g) + 3H2(g) 2NH3(g)
Trong phản ứng này, số oxi hoá của nitrogen giảm từ 0 xuống -3.
- Phương trình hoá học chứng minh nitrogen có tính khử:
N2(g) + O2(g) 2NO(g)
Trong phản ứng này, số oxi hoá của nitrogen tăng từ 0 lên +2.
Câu 14:
13/07/2024Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường, chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hoá học nhất. Vì sao?
a) N2 (g) → 2N (g) Eb = 945 kJ/mol.
b) H2 (g) → 2H (g) Eb = 432 kJ/mol.
c) O2 (g) → 2O (g) Eb = 498 kJ/mol.
d) Cl2 (g) → 2Cl (g) Eb = 243 kJ/mol.
 Xem đáp án
Xem đáp án
Năng lượng liên kết càng lớn, liên kết càng bền. Do đó trong các chất nitrogen, hydrogen, oxygen, chlorine ta có:
+ Nitrogen khó tham gia phản ứng hoá học nhất.
+ Chlorine dễ tham gia phản ứng hoá học nhất.
