Giải SBT Khoa học tự nhiên 8 KNTT Bài 3. Mol và tỉ khối chất khí
Giải SBT Khoa học tự nhiên 8 KNTT Bài 3. Mol và tỉ khối chất khí
-
717 lượt thi
-
19 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Tính số mol nguyên tử hoặc mol phân tử trong những lượng chất sau:
b) 1,505.1024 phân tử SO2.
c) 7,224.1023 nguyên tử Na.
Câu 2:
23/07/2024Tính số nguyên tử hoặc phân tử có trong những lượng chất sau:
b) 1,15 mol nguyên tử C.
c) 0,05 mol phân tử O2.
d) 2 mol phân tử NO2.
 Xem đáp án
Xem đáp án
a) 0,1.6,022.1023 = 6,02.1022 nguyên tử O.
b) 1,15.6,022.1023 = 6,93.1023 nguyên tử C.
c) 0,05.6,022.1023 = 3,11.1022 phân tử O2.
d) 2.6,022.1023 = 1,204.1024 phân tử NO2.
Câu 4:
23/07/2024Tính khối lượng (theo đơn vị gam) của những lượng chất sau:
 Xem đáp án
Xem đáp án
a) Khối lượng sắt là: mFe = 0,15.56 = 8,4 (g).
b) Khối lượng mol phân tử SO2 là: 32 + 16.2 = 64 (g/mol).
Khối lượng SO2 là: mSO2= 1,12.64 =71,68 (g).
c) Khối lượng mol phân tử NaCl là: 23 + 35,5 = 58,5 (g/mol)
Khối lượng NaCl là: mNaCl = 58,5.0,1 = 5,85 (g);
Khối lượng mol phân tử đường là: 12.12 + 22.1 + 11.16 = 342 (g/mol)
Khối lượng đường là: mđường = 0,2.342 = 68,4 (g).
Khối lượng hỗn hợp: 5,85 + 68,4 = 74,25 (g).
d) Khối lượng mol phân tử C2H5OH là: 2.12 + 6.1 + 16 = 46 (g/mol)
Khối lượng C2H5OH là: mC2H5OH = 1.46 =46(g);
Khối lượng mol phân tử nước là: 2.1 + 16 = 18 (g/mol)
Khối lượng nước là: mnước = 2.18 = 36 (g)
Khối lượng dung dịch là: 46 + 36 = 82 (g).
Câu 5:
22/07/2024Lượng chất nào sau đây chứa số mol nhiều nhất?
A. 16 gam O2
B. 8 gam SO2.
C. 16 gam CuSO4.
D. 32 gam Fe2O3.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
|
Chất |
O2 |
SO2 |
CuSO4 |
Fe2O3 |
|
Khối lượng |
16 |
8 |
16 |
32 |
|
Số mol tính được |
0,5 |
0,125 |
0,1 |
0,2 |
Câu 6:
22/07/2024Hãy tính:
a) Số mol nguyên tử Cl có trong 36,5 gam hydrochloric acid (HCl).
b) Số mol nguyên tử O có trong 11 gam khí carbon dioxide (CO2).
 Xem đáp án
Xem đáp án
a) Số mol phân tử HCl: 36,536,5=1 (mol)
Trong 1 phân tử HCl có 1 nguyên tử Cl.
Vậy: 1 mol phân tử HCl có 1 mol nguyên tử Cl.
b) Số mol phân tử CO2 là: 1144=0,25 (mol)
Trong 1 phân tử CO2 có hai nguyên tử O.
Vậy: 0,25 mol phân tử CO2 có 0,5 mol nguyên tử O.
c) Số mol phân tử C12H22O11: 3,42342=0,01 (mol)
Trong 1 phân tử C12H22O11 có 11 nguyên tử C.
Vậy: 0,01 mol phân tử C12H22O11 có 0,11 mol nguyên tử C.
Câu 7:
22/07/2024 Xem đáp án
Xem đáp án
a) VCH4=24,79.1,5=37,185(L).
b) Số mol N2 là: nN2=4228=1,5 (mol)
VN2= 24,79.1,5 =37,185 (L).
c) Số mol H2 là: nH2=3,01.10226,022.1023=0,05 (mol)
VH2=24,79.0,05=1,2395(L).
Câu 8:
23/07/2024Tìm thể tích ở 25 °C, 1 bar của những lượng khí sau:
a) Hỗn hợp gồm 1 mol CO2 và 1 mol O2.
 Xem đáp án
Xem đáp án
a) Tổng số mol khí là: 1 + 1 = 2 (mol).
Thể tích hỗn hợp là: Vhỗn hợp = 24,79.2 = 49,58 (L).
b) Tổng số mol khí là: 0,05 + 0,15 + 0,2 = 0,4 (mol).
Thể tích hỗn hợp là: Vhỗn hợp = 24,79.0,4 = 9,916 (L).
c) Số mol O2: nO2=1032= 0,3125 (mol).
Số mol N2: nN2=1428 = 0,5 (mol).
Tổng số mol khí: 0,3125 + 0,5 = 0,8125 (mol).
Thể tích hỗn hợp: Vhỗn hợp = 24,79.0,8125 = 20,142 (L).
Câu 9:
23/07/2024Ở điều kiện 25 °C, 1 bar, một quả bóng cao su chứa đầy khí carbon dioxide (CO2) có thể tích 2 L. Hãy tính khối lượng khí carbon dioxide trong quả bóng.
Câu 11:
15/07/2024Trong các câu sau đây, câu nào đúng, câu nào sai?
a) Trong 0,12 mol phân tử Cl2 có 0,06 mol nguyên tử Cl.
b) Số nguyên tử O trong 0,15 mol phân tử O2 và trong 0,1 mol phân tử O3 bằng nhau.
c) Ở cùng điều kiện nhiệt độ và áp suất, thể tích của 0,1 mol khí H2 bằng thể tích của hỗn hợp gồm 1 mol khí HCl và 0,1 mol khí HBr.
 Xem đáp án
Xem đáp án
a) Sai vì 0,12 mol phân tử Cl2 có 0,24 mol nguyên tử Cl.
b) Đúng vì số mol nguyên tử O trong 0,15 mol phân tử O2 là 0,3 mol; số mol nguyên tử O trong 0,1 mol phân tử O3 cũng là 0,3 mol.
c) Sai vì ở cùng điều kiện nhiệt độ và áp suất, thể tích của 0,1 mol khí H2 nhỏ hơn thể tích của hỗn hợp gồm 1 mol khí HCl và 0,1 mol khí HBr.
Câu 12:
21/07/2024Ở cùng điều kiện nhiệt độ và áp suất, có 4 quả bóng giống hệt nhau, chứa lần lượt các khí He, H2, Cl2, CO2. Hãy cho biết: khối lượng khí trong quả bóng nào lớn nhất, khối lượng khí trong quả bóng nào nhỏ nhất.
 Xem đáp án
Xem đáp án
Ở cùng điều kiện nhiệt độ, áp suất, số mol khí trong 4 quả bóng giống hệt nhau sẽ bằng nhau. Như vậy, khối lượng khí sẽ tỉ lệ thuận với khối lượng phân tử của các khí.
Vậy, khối lượng khí trong các quả bóng giảm dần như sau: H2 < He < CO2 < Cl2.
Hay khối lượng khí trong quả bóng chứa Cl2 là lớn nhất; khối lượng khí trong quả bóng chứa H2 là bé (nhỏ) nhất.
Câu 13:
20/07/2024Bơm đầy một loại khí vào quả bóng, thấy quả bóng bị đẩy bay lên. Hỏi trong quả bóng có thể chứa những loại khí nào sau đây?
Acetylene (C2H2); oxygen (O2); hydrogen (H2); carbon dioxide (CO2); sunfur dioxide (SO2).
Hãy giải thích.
 Xem đáp án
Xem đáp án
|
Khí |
C2H2 |
O2 |
H2 |
CO2 |
SO2 |
|
KLPT |
26 |
32 |
2 |
44 |
64 |
Quả bóng bị đẩy lên trên chứng tỏ khí trong quả bóng nhẹ hơn không khí, tức là khối lượng mol phân tử của khí đó nhỏ hơn 29 g/mol.
Các khí có thể chứa trong quả bóng đó: acetylene (C2H2) M = 26 g/mol, hydrogen (H2) M = 2 g/mol.
Câu 14:
23/07/2024Tính khối lượng mol trung bình của các hỗn hợp khí sau đây:
a) Hỗn hợp gồm H2 và Cl2 có tỉ lệ 1 : 1 về số mol.
b) Hỗn hợp gồm CO và N2 có tỉ lệ 2 : 3 về số mol.
c) Hỗn hợp gồm H2, CO2 và N2 có tỉ lệ 1 :2 :1 về số mol.
Cho biết công thức tính khối lượng mol phân tử trung bình của một hỗn hợp:
MTB=mhhnhh=M1.n1+M2.n2+....n1+n2+....
Trong đó:
MTB là khối lượng mol phân tử trung bình của hỗn hợp.
M1, M2... là khối lượng mol của các chất trong hỗn hợp.
n1, n2,... là số mol tương ứng của các chất.
 Xem đáp án
Xem đáp án
a) Khối lượng mol trung bình của hỗn hợp:
MTB=2.1+71.11+1=36,5(g/mol);
b) Khối lượng mol trung bình của hỗn hợp:
MTB=28.2+28.32+3=28(g/mol);
c) Khối lượng mol trung bình của hỗn hợp:
MTB=2.1+44.2+28.11+2+1=29,5(g/mol);
Câu 15:
23/07/2024Trong các hỗn hợp khí ở câu 3.14, hỗn hợp nào nặng hơn không khí, hỗn hợp nào nhẹ hơn không khí? Tính tỉ khối đối với không khí của các hỗn hợp trên.
 Xem đáp án
Xem đáp án
Hỗn hợp (a), (c) nặng hơn không khí; hỗn hợp (b) nhẹ hơn không khí.
Tỉ khối của các hỗn hợp so với không khí:
dhh(a)/kk=36,529=1,259;dhh(b)/kk=2829=0,966;dhh(c)/kk=29,529=1,017.Câu 16:
23/07/2024Trong phòng thí nghiệm có các dụng cụ và hoá chất sau: ống đong (giới hạn đo là 100 mL, độ chia nhỏ nhất là 1 mL), ống hút, ethanol (công thức phân tử là C2H5OH). Hãy trình bày cách lấy một lượng ethanol bằng 1,56 mol, biết rằng khối lượng riêng của ethanol là 0,78 g/mL.
 Xem đáp án
Xem đáp án
Khối lượng ethanol cần lấy: methanol = 1,56.46 = 71,76 gam.
Thể tích ethanol cần lấy: Vethanol = mD=71,760,78=92(mL).
Vậy: dùng ống đong lấy 92 mL ethanol, đó là 1,56 mol ethanol.
Câu 17:
23/07/2024Tính khối lượng không khí có trong một lớp học dạng hình hộp chữ nhật có chiều dài 10 m, chiều rộng 6 m và cao 3,5 m. Biết rằng nhiệt độ phòng là 25 °C và áp suất không khí trong phòng là 1 bar. Coi không khí có gần đúng 20% O2 và 80% N2 về thể tích.
 Xem đáp án
Xem đáp án
Thể tích không khí trong lớp học: 10 . 6 . 3,5 = 210 (m3).
Thể tích oxygen: 210.20% = 42 (m3) = 42 000 L.
Số mol oxygen:42 00024,79=1694 (mol).
Khối lượng oxygen: moxygen = 1694 . 32 = 54 208 (g).
Thể tích nitrogen: 210.80% = 168 (m3) = 168 000 L.
Số mol nitrogen: 16800024,79=6777(mol)
Khối lượng nitrogen: mnitrogen = 6777.28 = 189 756(g).
Khối lượng không khí trong lớp học:
mkk = 54 208 + 189 756 = 243 946 (g) = 243,946 kg.
Câu 18:
21/07/2024a) Có hai hỗn hợp khí như sau:
(1) Hỗn hợp CO và C2H6 có tỉ lệ 1 : 2 về số mol.
(2) Hỗn hợp CH4 và CO2 có tỉ lệ 2 : 1 về số mol.
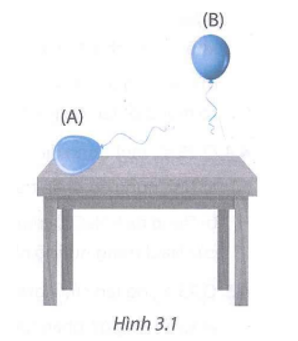
Bơm các hỗn hợp khí trên vào quả bóng A và B giống hệt nhau. Quan sát thấy hiện tượng như Hình 3.1.
a) Quả bóng A và B lần lượt chứa hỗn hợp khí nào?
b) Nếu một quả bóng được bơm đầỵ bằng không khí, nó sẽ bị đẩy bay lên hay nằm trên mặt bàn?
 Xem đáp án
Xem đáp án
a) Khối lượng mol phân tử trung bình của hỗn hợp 1:
Mhh(1)=28.1+30.21+2=29,333(g/mol)
Khối lượng mol phân tử trung bình của hỗn hợp 2:
Mhh(2)=16.2+44.12+1=25,333(g/mol)
Quả bóng B bay lên nên suy ra sẽ chứa hỗn hợp khí có khối lượng mol phân tử trung bình nhỏ hơn không khí. Vậy B chứa hỗn hợp (2).
Còn lại quả bóng A chứa khí nặng hơn không khí, không bay lên được. Vậy A chứa hỗn hợp (1).
b) Nếu một quả bóng được bơm đầy bằng không khí, nó sẽ nằm trên mặt bàn.
Câu 19:
21/07/2024Làm bay hơi hoàn toàn m gam ethanol (C2H5OH), thấy thể tích thu được đúng bằng thể tích của 14 gam nitrogen (N2) ở cùng điểu kiện nhiệt độ và áp suất. Tính m.
 Xem đáp án
Xem đáp án
Ở cùng điều kiện nhiệt độ và áp suất, nếu 2 khí có cùng thể tích thì có cùng số mol.
Số mol khí nitrogen là: nN2=1428=0,5(mol)
Vậy số mol ethanol cũng là 0,5 mol.
Suy ra khối lượng ethanol là: m = 46.0,5 = 23 (gam).
Có thể bạn quan tâm
- Trắc nghiệm KHTN 8 KNTT Bài 3: Mol và tỉ khối chất khí (445 lượt thi)
Các bài thi hot trong chương
- Trắc nghiệm KHTN 8 KNTT Bài 6: Tính theo phương trình hoá học (564 lượt thi)
- Trắc nghiệm KHTN 8 KNTT Bài 4: Dung dịch và nồng độ (530 lượt thi)
- Trắc nghiệm KHTN 8 KNTT Bài 2: Phản ứng hoá học (305 lượt thi)
- Trắc nghiệm KHTN 8 KNTT Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học (292 lượt thi)
- Trắc nghiệm KHTN 8 KNTT Bài 7: Tốc độ phản ứng và chất xúc tác (246 lượt thi)