Giải SBT Hóa học 11 CTST Bài 19: Carboxylic acid
Giải SBT Hóa học 11 CTST Bài 19: Carboxylic acid
-
76 lượt thi
-
30 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
18/07/2024Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
A. CnH2nO2 (n ≥ 1).
B. CnH2n+2O2 (n ≥ 1)
C. CnH2n-1COOH (n ≥ 1).
D. CnH2nO2 (n ≥ 2)
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
CnH2nO2 (n ≥ 1).
Câu 2:
17/07/2024Vị chua của giấm là do chứa
A. acetic acid.
B. salicylic acid.
C. oxalic acid.
D. citric acid.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vị chua của giấm là do chứa acetic acid.
Câu 3:
17/07/2024Benzoic acid được sử dụng như một chất bào quản thực phẩm (kí hiệu là E-210) cho xúc xích, nước sốt cà chua, mù tạt, bơ thực vật,… vì có tác dụng ức chế sự phát triển của nấm mốc, nấm men và một số vi khuẩn. Công thức của benzoic acid là
A. CH3COOH.
B. C6H5COOH.
C. HOOC-COOH.
D. HCOOH.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức của benzoic acid là C6H5COOH.
Câu 4:
19/07/2024Cho các chất sau: (1) C3H8, (2) C2H5OH, (3) CH3CHO, (4) CH3COOH. Thứ tự các chất theo chiều tăng dần nhiệt độ sôi từ trái sang phải là
A. (1), (2), (3), (4). B. (4), (3), (2), (1).
C. (1), (2), (4), (3). D. (1), (3), (2), (4).
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi phân tử khối của các chất chênh lệch nhau không nhiều thì nhiệt độ sôi của các chất tăng dần từ alkane < aldehyde < alcohol < carboxylic acid.
Câu 5:
20/07/2024Tên gọi của CH3CH(CH3)CH2COOH là
A. 2-methylpropanoic acid.
B. 2-methylbutanoic acid,
C. 3-methylbutanoic acid.
D. 3-methylpropanoic acid
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tên gọi của CH3CH(CH3)CH2COOH là 3-methylbutanoic acid.Câu 6:
17/07/2024Methyl salicylate trong thuốc giảm đau được điều chế bằng cách cho salicylic acid phản ứng với methanol có H2SO4 đặc làm xúc tác, đun nóng. Cho 0,1 mol methyl salicylate phản ứng với dung dịch NaOH dư, số mol NaOH đã tham gia phản ứng là
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,05 mol.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình hóa học:
HOOC-C6H4-OH + CH3OH HO-C6H4-COOCH3 + H2O
salicylic acid methyl salicylate
HO-C6H4-COOCH3 + 2NaOH → NaOOC-C6H4-ONa + CH3OH + H2O
0,1 → 0,2 (mol)
Câu 7:
17/07/2024Trung hòa 100 mL dung dịch carbonxylic acid (X) nồng độ 0,1 M cần vừa đủ 16 gam dung dịch NaOH 5%, thu được 1,48 gam muối. Công thức cấu tạo của (X) là
A. HOOC-CH2-COOH.
B. HOOC-COOH.
C. CH3-COOH.
D. HOOC-CH2-CH2-COOH.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Từ đề bài, ta có: nx = 0,1 × 0,1 = 0,01 (mol).
=> (X) là carboxylic acid hai chức.
=> nmuối= 0,01 mol =>Mmuối= = 148
=> Mx= 148-23×2 + 1×2 = 104.
=> (X) có công thức cấu tạo là HOOC-CH2-COOH.
HOOC-CH2-COOH + 2NaOH → NaOOC-CH2-COONa + 2H2O
Câu 8:
22/07/2024Cho dãy các chất sau: HCHO, CH3COOH, CH3CHO, HCOOH, C2H5OH. Số chất trong dãy có thể tham gia phản ứng tráng bạc là
A. 3.
B. 6.
C. 4.
D. 5.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chất có thể tham gia phản ứng tráng bạc là: HCHO, CH3CHO, HCOOH.
Câu 9:
21/07/2024Cho dung dịch acetic acid có nồng độ x% tác dụng vừa đủ với dung dịch NaOH 20% thu được dung dịch muối sodium acetate có nồng độ 10,25%. Giá trị của X là
A. 10%. B. 15%. C. 18,67%. D. 20%.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi a là số mol CH3COOH phản ứng.
Phương trình hoá học:
CH3COOH + NaOH → CH3COONa + H2O
(mol) a → a
=>
=> =>
=>
Câu 10:
15/07/2024Hợp chất hữu cơ (X) có công thức phân tử là C3H4O2. (X) tác dụng được với dung dịch sodium hydroxide và dung dịch bromine. Tên gọi của (X) là
A. methyl acetate.
B. acrylic acid.
C. propane-1,3-diol.
D. acetone.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
(X) tác dụng được với dung dịch NaOH và dung dịch bromine, vậy (X) là acid không no. (X) là CH2=CH-COOH (acrylic acid).
Câu 11:
23/07/2024Rót 1 - 2 mL dung dịch chất (X) đậm đặc vào ống nghiệm đựng 1 - 2 mL dung dịch NaHCO3. Đưa que diêm đang cháy vào miệng ống nghiệm thì que diêm tắt. Chất (X) có thể là chất nào sau đây?
A. Ethanol.
B. Acetaldehyde.
C. Acetic acid.
D. Phenol.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
Que diêm đang cháy cho vào miệng ống nghiệm thì que diêm tắt do có CO2 tạo thành.
Câu 12:
20/07/2024Phương pháp nào sau đây được dùng để sản xuất giấm ăn?
A. 2CH3CHO + O2 2CH3COOH
B. CH3COOCH3 + H2O CH3COOH + CH3OH
C. C2H2 + H2O → CH3CHO CH3COOH
D. C2H5OH + O2 CH3COOH + H2O
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương pháp được dùng để sản xuất giấm ăn là
C2H5OH + O2 CH3COOH + H2O
Câu 13:
23/07/2024Cho các chất sau: (X) CH3CH2CHO; (Y) CH2=CHCHO; (Z) (CH3)2CHCHO; (T) CH2=CHCH2OH. Các chất phản ứng hoàn toàn với lượng dư khí hydrogen có chất xúc tác Ni, đun nóng, tạo ra cùng một sản phẩm là
A. (X), (Y), (Z).
B. (X), (Y), (T).
C. (Y), (Z), (T).
D. (X), (Z), (T).
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
CH3CH2CHO + H2 CH3CH2CH2OH
CH2=CHCHO + 2H2 CH3CH2CH2OH
CH2=CHCH2OH + H2 CH3CH2CH2OH
Câu 14:
21/07/2024Thứ tự các thuốc thử để phân biệt 3 dung dịch riêng biệt: acetic acid, acrylic acid, formic acid là
A. quỳ tím, dung dịch Br2 trong CCI4.
B. dung dịch Br2, dung dịch Na2CO3.
C. dung dịch Na2CO3, quỳ tím.
D. dung dịch AgNO3 trong NH3 dư, dung dịch Br2.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ban đầu, dùng dung dịch AgNO3 trong NH3 dư để nhận biết formic acid vì phản ứng sẽ sinh ra kết tủa Ag. Sau đó, dùng dung dịch Br2 để nhận biết acrylic acid vì làm mất màu dung dịch Br2. Dung dịch còn lại là acetic acid.
HCHO + 4[Ag(NH3)2]OH (NH4)2CO3 + 4Ag↓ + 6NH3 + 2H2O
CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
Câu 15:
20/07/2024Cho sơ đồ phản ứng:
(X) (Y) (Z) (T) (Q) methyl acrylate
Biết (Y), (Z), (T), (Q) là các sản phẩm chính của phản ứng. Xác định tên gọi của các chất trong sơ đồ và viết phản ứng xảy ra.
 Xem đáp án
Xem đáp án
(X) là propene.
Phương trình hoá học:
CH2=CH-CH3 + Cl2 CH2=CH-CH2Cl + HCl
CH2=CH-CH2Cl + NaOH CH2=CH-CH2OH + NaCl
allyl chloride allylic alcohol
CH2=CH-CH2OH + CuO CH2=CH-CHO + Cu + H2O
2CH2=CH-CHO + O2 2CH2=CH-COOH
acrylic aldehyde acrylic acid
CH2=CH-COOH + CH3OH CH2=CH-COOCH3 + H2O
methyl acrylate
Câu 16:
22/07/2024Sơ đồ điều chế ethanol từ tinh bột:
Tinh bột glucose ethanol
Lên men 162 gam tinh bột với hiệu suất các giai đoạn lần lượt là 80% và 90%. Tính thể tích ethanol 40° thu được. Biết khối lượng riêng của C2H5OH nguyên chất là 0,79 g/mL.
 Xem đáp án
Xem đáp án
Phương trình hoá học:
(C6H10O5)n + nH2O nC6H12O6 (H1 = 80%)
C6H12O6 2C2H5OH + 2CO2 (H2 = 90%)
Theo phương trình: ntinhbột = 1 mol => nethanol = 2 mol => methanol (LT) = 92 gam
Do hiệu suất các giai đoạn là 80% và 90% nên
H = 80×90% = 72%
Khối lượng ethanol thực tế: methanol (TT) = 92 × 72% = 66,24 (g).
Thể tích dung dịch ethanol 40° là:
Câu 17:
21/07/2024Sữa chua được biết đến là một loại thực phẩm có giá trị dinh dưỡng cao và tốt cho sức khoẻ. Quá trình chủ yếu xảy ra trong giai đoạn lên men sữa chua là đường lactose chuyển thành đường glucose, sau đó tiếp tục chuyển thành pyruvic acid và cuối cùng là lactic acid theo sơ đồ sau.
C12H22O11 C6H12O6 C3H6O3
(a) Lactic acid có công thức cấu tạo là CH3CH(OH)COOH. Hãy gọi tên theo danh pháp thay thế của lactic acid.
(b) Hoàn thành các phản ứng trong sơ đồ phản ứng trên.
 Xem đáp án
Xem đáp án
(a) Tên thay thế của lactic acid là 2-hydroxypropanoic acid.
(b) C12H22O11 + H2O 2C6H12O6
CH3OH[CH(OH)]4CHO 2CH3-CH(OH)-COOH
Câu 18:
23/07/2024Hoàn thành sơ đồ sau với điều kiện đề phản ứng xảy ra, gọi tên của sản phẩm thu được:
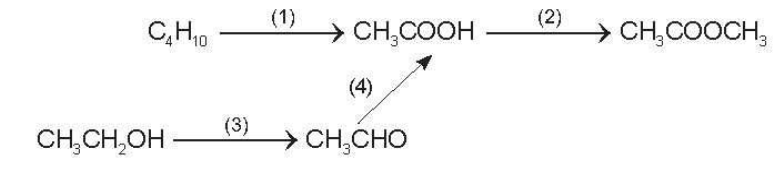
 Xem đáp án
Xem đáp án
(1) 2C4H10+ 5O2 4CH3COOH + 2H2O
acetic acid
(2) CH3COOH + CH3OH CH3COOCH3 + H2O
methyl acetate
(3) 2CH3CH2OH + O2 2CH3CHO + 2H2O
ethanal
(4) 2CH3CHO + O2 2CH3COOH
Câu 19:
11/07/2024Cho enthalpy tạo thành tiêu chuẩn của các chất trong bảng sau.
|
Chất |
C6H6 (l) |
C2H5OH (l) |
CH3COOH (l) |
CO2 (g) |
H2O (g) |
|
(kJ/mol) |
49,00 |
-277,63 |
-487,00 |
-393,50 |
-241,82 |
(a) Viết phương trình đốt cháy hoàn toàn C6H6, C2H5OH và CH3COOH với hệ số nguyên tối giản.
b) Chất nào trong các chất trên có biến thiên enthalpy của phản ứng lớn hơn ( âm hơn).
c) Từ kết quả tính toán hãy so sánh biến thiên enthalpy của phản ứng khi đốt cháy cùng khối lượng C6H6, C2H5OH và CH3COOH.
 Xem đáp án
Xem đáp án
(a) Phương trình đốt cháy hoàn toàn các chất:
2C6H6(l) + 15O2(g) 12CO2(g) + 6H2O(g) (1)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g) (2)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g) (3)
b) Biến thiên enthanpy của phản ứng:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(g)
= 6× (CO2) + 3× (H2O)- (C6H6)
= 6 ×(-393,5) + 3×(-241,82) - 49,00 = -3 135,46 (kJ)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g)
= 2× (CO2) + 3× (H2O)- (C2H5OH)
= 2 ×(-393,5) + 3×(-241,82) – (-277,63) = -1 234,83 (kJ)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g)
= 2× (CO2) + 3× (H2O)- ( CH3COOH)
= 2 ×(-393,5) + 3×(-241,82) – (-487,00) = -783,64 (kJ)
c) Biết ; ; .
Xét khi đốt cháy cùng khối lượng là 78 gam thì
C6H6 có =-3 135,46 kJ;
C2H5OH có = -2 093,84 kJ;
CH3COOH có = -1 018,73 kJ.
Vậy khi đốt cháy cùng khối lượng thì biến thiên enthalpy của phản ứng đốt cháy các chất theo thứ tự giảm dần C6H6, C2H5OH, CH3COOH.
Câu 20:
14/07/2024Formic acid là một chất lỏng, mùi xốc mạnh và gây bỏng da, acid này được chưng cất lần đầu từ loài kiến lửa có tên là Formicarufa. Kiến khi cắn sẽ “tiêm” dung dịch chứa 50% thể tích formic acid vào da. Trung bình mỗi lần cắn, kiến có thể “tiêm” khoảng 6,0×10−3 cm3 dung dịch formic acid.
(a) Biết mỗi lần cắn, kiến “tiêm” 80% formic acid có trong cơ thể. Giả sử lượng formic acid trong các con kiến là bằng nhau. Hãy xác định thể tích formic acid tinh khiết có trong một con kiến.
(b) Để làm giảm lượng formic acid trong vết cắn, bác sĩ thường dùng thuốc có chứa thành phần là sodium hydrogencarbonate (NaHCO3). Hãy viết phương trình hoá học của phản ứng và tính khối lượng sodium hydrogencarbonate cần dùng để trung hoà hoàn toàn lượng formic acid từ vết kiến cắn (biết khối lượng riêng của formic acid là 1,22 g/cm3).
 Xem đáp án
Xem đáp án
a) Thể tích HCOOH có trong 1 con kiến:
VHCOOH = 6×10-3 × × =3,75×10-3 (cm3).
b) Phương trình hoá học của phản ứng:
HCOOH + NaHCO3 → HCOONa + CO2↑ + H2O
Theo phương trình hoá học:
Khối lượng NaHCO3 cần dùng là:
= 7,96×10-5×84 = 6,69×10-3 (g) = 6,69 (mg).
Câu 21:
17/07/2024Giấm ăn được điều chế bằng cách lên men dung dịch ethanol loãng. Hãy tính khối lượng giấm ăn 5% thu được khi lên men 100 L ethanol 4°. Biết hiệu suất quá trình lên men là 80%, khối lượng riêng của ethanol nguyên chất là 0,79 g/mL.
 Xem đáp án
Xem đáp án
vethanol = = 4 (L) = 4 000 (mL).
methanol = 0.79×4 000 = 3 160 (g).
Phản ứng lên men:
C2H5OH + O2 CH3COOH + H2O
Theo phản ứng: mgiấm ăn(LT)= 4 121,74 (g).
Với hiệu suất 80% thì khối lượng thực tế thu được:
mgiấm ăn (TT) = mgiấm ăn(LT)×80%= 4 121,74× 80% = 3 297,39 (g).
Khối lượng giấm ăn 5%:
Mdd giấm ăn 5% =
Câu 22:
21/07/2024Hè năm ngoái, An được bố mẹ cho về quê thăm ông bà nội. Trong vườn của ông bà có rất nhiều cây ăn quả. Một hôm, An treo lên cây hái quả, không may bị ong đốt. Bà của An đã dùng một ít vôi bôi vào chỗ ong đốt, vết thương đỡ bị sưng và giảm đau hơn. Em hãy giải thích tại sao bà của bạn An lại làm như vậy.
 Xem đáp án
Xem đáp án
Trong nọc ong có formic acid (HCOOH). Bà của An đã dùng một ít vôi bôi vào chỗ ong đốt để trung hoà acid HCOOH theo phương trình:
2HCOOH + Ca(OH)2 → (HCOO)2Ca + 2H2O
Khi formic acid được trung hoà thì vết thương đỡ bị sưng và giảm đau hơn.
Câu 23:
18/07/2024Ethyl acetate là chất lỏng, có mùi đặc trưng, được sản xuất ở quy mô lớn làm dung môi trong công nghiệp.
(a) Viết phương trình hoá học điều chế ethyl acetate bằng cách đun nóng hỗn hợp acetic acid với ethanol, xúc tác H2SO4 đặc.
(b) Sơ đồ thí nghiệm sau mô tả quá trình thực hiện phản ứng trên. Hãy cho biết vai trò của cốc nước lạnh trong thí nghiệm. Sau khi kết thúc phản ứng, ta thêm một ít nước vào ống nghiệm, lắc nhẹ thì có hiện tượng gì xảy ra?
(c) Để một nhà máy sản xuất được 1 000 L ethyl acetate mỗi ngày thì lượng thể tích (L) ethanol và acetic acid tiêu thụ tối thiểu là bao nhiêu? Biết rằng hao hụt trong quá trình sản xuất trên là 34%.
Cho khối lượng riêng (g/cm3) của ethyl acetate, ethanol và acetic acid lần lượt là: 0,902; 0,79; 1,049.
 Xem đáp án
Xem đáp án
a) Phương trình hoá học:
C2H5OH + CH3COOH CH3COOC2H5 + H2O
b) Vai trò của cốc nước lạnh: ethyl acetate sinh ra dưới dạng hơi nên cần làm lạnh bằng nước đá để ngưng tụ.
Sau khi kết thúc phản ứng ta thêm một ít nước vào ống nghiệm, lắc nhẹ thì trong ống nghiệm có chất lỏng không màu, mùi đặc trưng, không tan trong nước và nổi trên mặt nước.
c)
C2H5OH + CH3COOH CH3COOC2H5 + H2O
(mol) 10 250 10 250 ← 10 250
Theo đề bài, hao hụt của phản ứng là 34%, do đó, hiệu suất của phản ứng là 66%.
Câu 24:
19/07/2024Nhận biết 4 dung dịch mất nhãn sau: ethanol, acetaldehyde, ethyl acetate và acetic acid bằng phương pháp hoá học.
 Xem đáp án
Xem đáp án
Trích mẫu thử, dùng quỳ tím thử các mẫu, chỉ có CH3COOH làm quỳ tím hoá đỏ. Các mẫu thử còn lại (C2H5OH, CH3CHO, CH3COOC2H5) không làm quỳ tím đổi màu.
Dùng Na cho tác dụng với các mẫu còn lại, chỉ có C2H5OH cho sủi bọt khí H2, các mẫu thử còn lại (CH3CHO, CH3COOC2H5) không hiện tượng.
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Hai mẫu còn lại thực hiện phản ứng tráng bạc, acetaldehyde có hiện tượng tráng bạc, ethyl acetate không có hiện tượng, mẫu còn lại là ethyl acetate.
CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag↓ + 3NH3 + H2O
Hoặc có thể trình bày dưới dạng bảng. Trích mẫu thử, sử dụng các thuốc thử, kết quả thu được ở bảng sau:
|
Thuốc thử |
CH3COOH |
C2H5OH |
CH3CHO |
CH3COOC2H5 |
|
Quỳ tím |
hoá đỏ |
— |
— |
— |
|
Na |
— |
h2↑ |
— |
— |
|
[Ag(NH3)2]OH |
— |
— |
Ag↓ |
— |
Các phương trình hoá học:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag↓ + 3NH3 + H2O
Câu 25:
22/07/2024Viết 4 phương trình hoá học thực hiện sơ đồ chuyển hoá sau đây:
(X) (Y) (Z) (T) (Y)
Cho biết (X), (Y), (Z) và (T) là các chất hữu cơ, trong đó (Y) có nồng độ từ 2% đến 5% thì được gọi là giấm ăn.
 Xem đáp án
Xem đáp án
Dung dịch 2% - 5% của (Y) được gọi là giấm ăn ![]() (Y) là CH3COOH.
(Y) là CH3COOH.
Chọn (X), (Y), (Z) và (T) lần lượt là CH3CH2OH, CH3COOH, (CH3COO)2Ba và CH3COONa. Ta có:
(1) C2H5OH + O2 → CH3COOH + H2O
(2) 2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
(3) (CH3COO)2Ba + Na2SO4 → BaSO4↓ + 2CH3COONa
(4) CH3COONa + HCl → CH3COOH + NaCl
Chú ý: Học sinh có thể đề xuất các phản ứng khác (nếu đúng) phù hợp với sơ đồ trên.
Câu 26:
21/07/2024Hợp chất hữu cơ (X) có công thức phân tử là C4H6O2 nhưng chưa rõ công thức cấu tạo. Để tiến hành xác định công thức cấu tạo của chất, người ta đã thực nghiệm về tính chất của (X) thu được kết quả sau:
(X) làm quỳ tím chuyển màu đỏ;
- (X) làm mất màu nước bromine;
- Khi cho tác dụng với Na2CO3 tạo chất khí không màu.
(a) Tìm công thức cấu tạo có thể có của (X), gọi tên các đồng phân và cho biết cấu tạo nào có đồng phân hình học.
 Xem đáp án
Xem đáp án
a) (X) làm mất màu nước bromine nên (X) có chứa liên kết đôi trong phân tử. (X) làm quỳ tím chuyển màu đỏ, tạo chất khí không màu khi tác dụng với Na2CO3, vậy (X) là carboxylic acid.
Với công thức phân tử là C4H6O2 chứa liên kết đôi và mang nhóm chức carboxylic acid, các đồng phân có thể có của (X) là:
CH2=CH-CH2-COOH (1)
CH3CH=CH-COOH (2)
CH2=C(CH3)-COOH (3)
Trong đó (2) có đồng phân hình học (cis-, trans-).
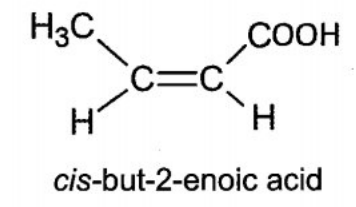
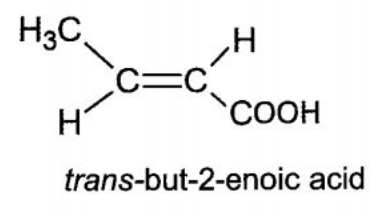
b) Các phương trình phản ứng:
- Đối với chất CH2=CH-CH2-COOH:
CH2=CH-CH2COOH + Br2 → CH2Br-CHBr-CH2COOH
2CH2=CH-CH2COOH + Na2CO3 → 2CH2=CH-CH2COONa + CO2↑ + H2O
- Đối với chất CH3CH=CH-COOH:
CH3CH=CH-COOH + Br2 → CH3CHBr-CHBr-COOH
2CH3CH=CH-COOH + Na2CO3 → 2CH3CH=CH-COONa + CO2↑ + H2O
- Đối với chất CH2=C(CH3)-COOH:
CH2=C(CH3)-COOH + Br2 → CH2Br-CBr(CH3)-COOH
2CH2=C(CH3)-COOH + Na2CO3 → 2CH2=C(CH3)-COONa + CO2↑ + H2O
Câu 27:
21/07/2024Sắp xếp theo trình tự tăng dần tính acid của các chất trong dãy sau:
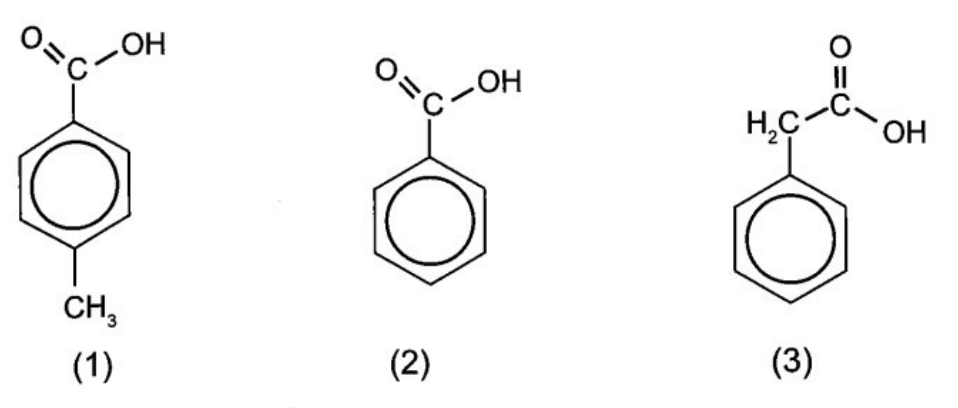
 Xem đáp án
Xem đáp án
Thứ tự giảm dần tính acid: (2) > (1) > (3).
Câu 28:
15/07/2024Cho sơ đồ chuyển hóa:
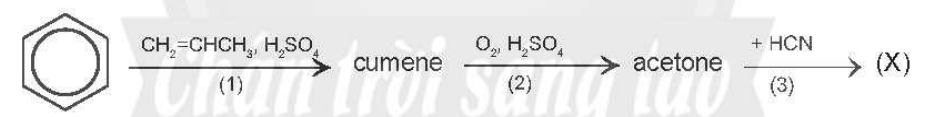
Hãy xác định (X), viết công thức cấu tạo các chất trong sơ đồ và hoàn thành các phản ứng.
 Xem đáp án
Xem đáp án
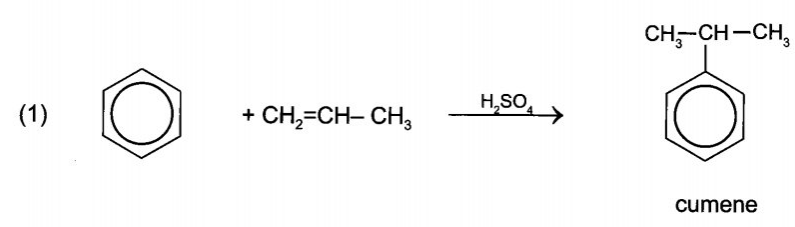
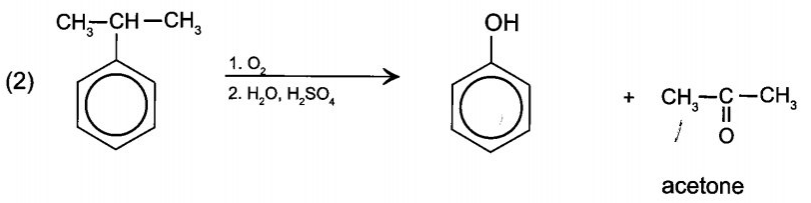
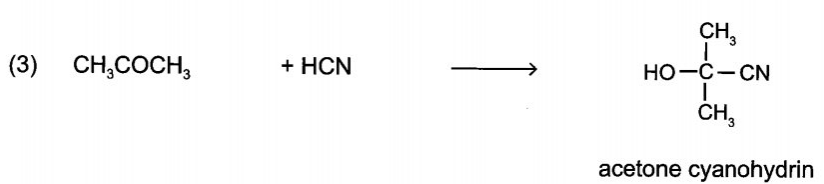
Vậy (X) là acetone cyanohydrin.
Câu 29:
23/07/2024Vị chua của trái cây là do các acid hữu cơ có trong đó gây nên. Trong quả táo có 2-hydroxybutane-1,4-dioic acid (malic acid), trong quả nho có 2,3-dihydroxybutanedioic acid (tartaric acid), trong quả chanh có 2-hydroxypropane-1,2,3-tricarboxylic acid (citric acid). Hãy viết công thức cấu tạo các acid đó.
 Xem đáp án
Xem đáp án
Công thức cấu tạo của malic acid (2-hydroxybutane-1,4-dioic acid) có trong táo
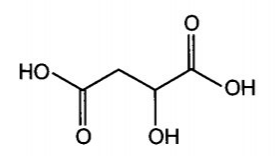
Công thức cấu tạo của tartaric acid (2,3-dihydroxybutane-1,4-dioic acid) có trong nho
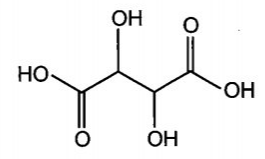
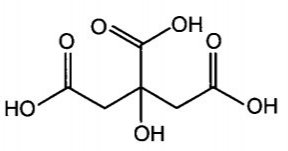
Công thức cấu tạo của citric acid (2-hydroxypropane-1,2,3-tricarboxylic acid) có trong chanh:
Câu 30:
16/07/2024Vì sao nước rau muống đang xanh khi vắt chanh vào thì chuyển sang màu đỏ?
 Xem đáp án
Xem đáp án
Các hợp chất hoá học có thể thay đổi màu theo pH của dung dịch được gọi là chất chỉ thị. Một số chất chỉ thị màu tự nhiên có trong các loại thực vật, trong đó có rau muống, hoa cẩm tú cầu, bắp cải tím, ... Trong chanh có chứa 7% citric acid, vắt chanh vào nước rau muống làm thay đổi pH, do đó làm thay đổi màu nước rau. Khi chưa vắt chanh, nước rau muống có màu xanh. Khi nhỏ acid vào làm chất chỉ thị màu trong nước rau muống bị chuyển màu.
