Giải SBT Hóa học 11 CTST Bài 13: Hydrocarbon không no
Giải SBT Hóa học 11 CTST Bài 13: Hydrocarbon không no
-
135 lượt thi
-
21 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
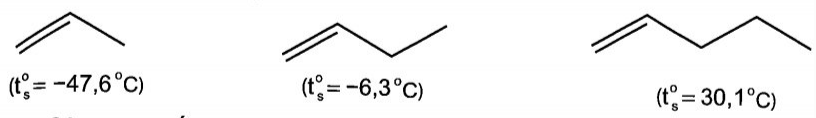
21/07/2024Biểu đồ dưới đây thể hiện mối tương quan giữa nhiệt độ sôi và số nguyên tử carbon trong phân tử alkene.
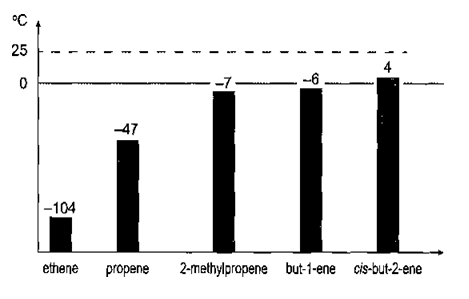
Nhiệt độ sôi của một số alkene
Có bao nhiêu alkene trong biểu đồ ở thể khí trong điều kiện thường (25oC)
A. 4. B. 2. C. 3. D. 5.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
cis-but-2-ene cũng ở thể khí trong điều kiện thường do có nhiệt độ sôi là 4 °C.
Câu 2:
19/07/2024Ứng với công thức phân tử C5H8 có bao nhiêu alkyne là đồng phân cấu tạo của nhau?
A. 3. B. 2. C. 5. D. 4.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Có 3 alkyne C5H8 là đồng phân cấu tạo của nhau, gồm
CH≡C-CH2-CH2CH3; CH≡C-CH-(CH3)2; CH3-C≡C-CH2-CH3.
Câu 3:
22/07/2024Cho các alkene sau:
1. CH2=CH-CH2-CH3 2. (CH3)2C=C(CH3)2
3. CH3-CH2-CH=CH-CH3 4. CH3-CH2-CH=CH-CH2-CH3
Số alkene có đồng phân hình học là
A. 4. B. 2. C. 3. D. 1.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Có 2 alkene đã nêu có đồng phân hình học là
CH3-CH2-CH=CH-CH3 và CH3-CH2-CH=CH-CH2-CH3:
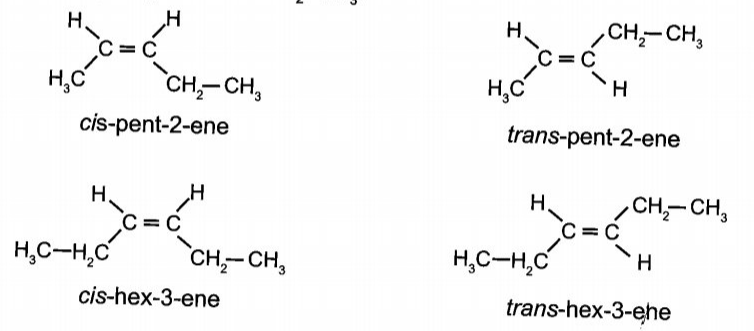
Câu 4:
21/07/2024Viết công thức khung phân tử của:
a) propene.
b) pent-1-ene.
c) 3-methylpent-1-yne.
d) cis-pent-2-ene.
e) trans-pent-2-ene
 Xem đáp án
Xem đáp án
Công thức khung phân tử các chất đã cho:
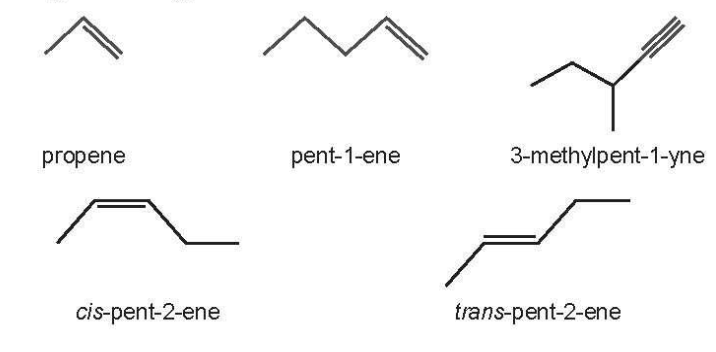
Câu 5:
19/07/2024Cho các phân tử alkene có công thức khung phân tử dưới đây:
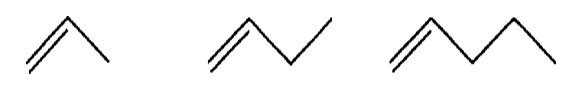
(A) (B) (C)
a) Gọi tên các phân tử alkene nêu trên theo danh pháp thay thế.
b) So sánh tương tác van der Waals giữa các phân tử alkene nêu trên. Từ đó em có kết luận gì?
 Xem đáp án
Xem đáp án
a) (A): propene, (B): but-1-ene và (C): pent-1-ene.
b) Đi từ propene đến pent-1 -ene, kích thước phân tử alkene tăng dần làm cho diện tích bề mặt tiếp xúc giữa chúng cũng tăng, tương tác van der Waals giữa các phân tử do đó cũng tăng dần, dẫn đến nhiệt độ sôi các alkene tăng dần. Ngoài ra, ở điều kiện thường, propene và but-1 -ene là các chất khí trong khi pent-1-ene là chất lỏng vì tương tác van der Waals giữa các phân tử propene và but-1-ene chưa đủ lớn. Các phân tử alkene có từ 18 nguyên tử carbon trở lên ở thể rắn, do tương tác van der Waals giữa chúng là mạnh đáng kể.
Câu 6:
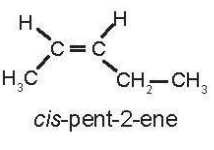
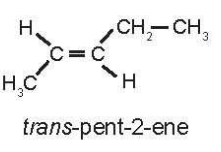
23/07/2024Viết công thức cấu tạo và gọi tên tất cả các alkene và alkyne có công thức phân tử lần lượt là C5H10 và C5H8. Trong tất cả các chất mà em đã liệt kê, chất nào có đồng phân hình học? Viết công thức và gọi tên các đồng phân hình học đó.
 Xem đáp án
Xem đáp án
Công thức cấu tạo của các alkene C5H10
CH3—CH2—CH2— CH=CH2: pent-1-ene
CH3— CH2—CH = CH—CH3: pent-2-ene
CH2=CH-CH-(CH3)2: 3-methylbut-1-ene
CH2=C(CH3)-CH2-CH3: 2-methylbut-1-ene
CH3)2-C=CH-CH3: 2-methylbut-2-ene
Công thức cấu tạo của các alkyne C5H8
CH≡C-CH2-CH2-CH3: pent-1-yne
CH≡C-CH-(CH3)2: 3-methylbut-1-yne
CH3-C≡C-CH2-CH3: pent-2-yne
Chỉ pent-2-ene có đồng phân hình học là:
Câu 7:
23/07/2024So sánh nhiệt độ sôi của các đồng phân cis, trans của cùng một phân tử alkene. Giải thích và cho ví dụ minh hoạ.
 Xem đáp án
Xem đáp án
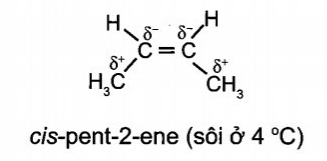
Đồng phân trans có tổng moment lưỡng cực thường triệt tiêu hoặc gần triệt tiêu, còn đồng phân cis có tổng moment lưỡng cực không triệt tiêu, do đó đồng phân trans có nhiệt độ sôi thấp hơn đồng phân cis.
Ví dụ phân tử cis-but-2-ene và trans-but-2-ene đều chứa nhóm –CH3 là nhóm đẩy electron làm phân tử mỗi chất hình thành các moment lưỡng cực yếu C-C như trong hình bên dưới. Tuy nhiên, cis-but-2-ene có tổng moment lưỡng cực không triệt tiêu, còn trans-but-2-ene có tồng moment lưỡng cực triệt tiêu. Do đó cis-but-2-ene là phân tử phân cực nhẹ trans-but-2-ene là phân tử không phân cực, dẫn đến nhiệt độ sôi của cis-but-2-ene cao hơn so với trans-but-2-ene.
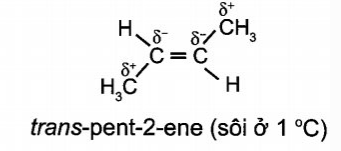
Câu 8:
21/07/2024Giải thích vì sao liên kết ba C≡C của một phân tử alkyne tuy giàu mật độ electron hơn so với liên kết đôi C=C của một phân tử alkene tương ứng nhưng khả năng phản ứng cộng (X2, HX, H2O) vào alkyne lại kém hơn vào alkene tương ứng?
 Xem đáp án
Xem đáp án
Tuy liên kết ba C≡C của một alkyne giàu mật độ electron hơn so với liên kết đôi C=C của một alkene tương ứng nhưng khả năng phản ứng cộng (X2, HX, H2O) vào alkyne lại kém hơn vào alkene tương ứng. Điều này có thể giải thích là do nguyên tử carbon trong liên kết C≡C ở trạng thái lai hoá sp, có độ âm điện lớn hơn các nguyên tử carbon trong liên kết C=C ở trạng thái lai hoá sp2, làm cho các electron π trong C≡C bị giữ chặt hơn so với các electron π trong C=C, dẫn đến khả năng phản ứng cộng (X2, HX, H2O) của alkyne kém hơn alkene tương ứng.
Ví dụ ethylene nhanh chóng làm mất màu nước bromine, acetylene làm mất màu nước bromine chậm hơn. Tốc độ mất màu nước bromine của ethylene gấp 5 lần so với acetylene.
Câu 9:
21/07/2024Giải thích vì sao liên kết π của frans-but-2-ene có mật độ electron cao hơn đáng kể so với liên kết π của trans-2,3-dibromobut-2-ene? Từ đó so sánh khả năng phản ứng cộng bromine của frans-but-2-ene và trans-2,3- dibromobut-2-ene.
 Xem đáp án
Xem đáp án
Do nguyên tử bromine có độ âm điện lớn hơn nguyên tử carbon nên liên kết C-Br bị phân cực mạnh về phía bromine, kết quả liên kết đôi của trans-2,3-dibromobut-2-ene có mật độ electron thấp hơn đáng kể so với liên kết đôi của trans-but-2-ene. Chính vì vậy khả năng phản ứng cộng bromine của trans-2,3-dibromobut-2-ene kém hơn so với frans-but-2-ene.
Câu 10:
23/07/2024So sánh khả năng phản ứng cộng bromine vào liên kết ba C≡C của một alkyne và vào liên kết đôi C=C của một dibromoalkene tương ứng. Giải thích.
 Xem đáp án
Xem đáp án
Phản ứng cộng bromine vào liên kết ba C≡C của một alkyne dễ hơn vào liên kết đôi C=C của một dibromoalkene tương ứng. Điều này được giải thích là do nguyên tử bromine có độ âm điện mạnh, đã làm liên kết C-Br phân cực mạnh về phía bromine, làm mật độ electron trên liên kết đôi của dibromoalkene kém hơn hẳn so với trên liên kết ba của alkyne tương ứng.
Câu 11:
22/07/2024Hoàn thành các phương trình phản ứng sau (nêu rõ sản phẩm chính, phụ nếu có).
a) →
b) CH=C-CH3+ Br2
c) CH3-CH2-CH = CH2 + HBr →
d) CH3-C≡C-CH3 +HCl
e) CH3-CH2-C≡C-CH2-CH3 + H2O
g) CH2=CCl-CH3 + HCl →
 Xem đáp án
Xem đáp án
a)
b)
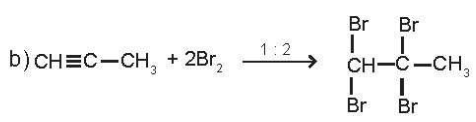
c)
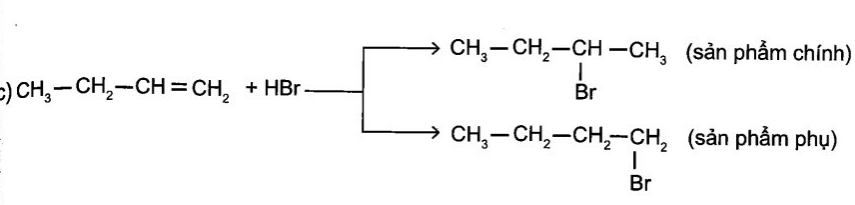
d)
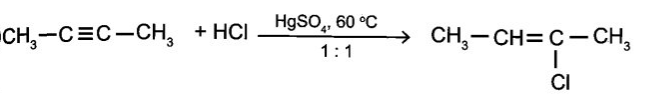
e)
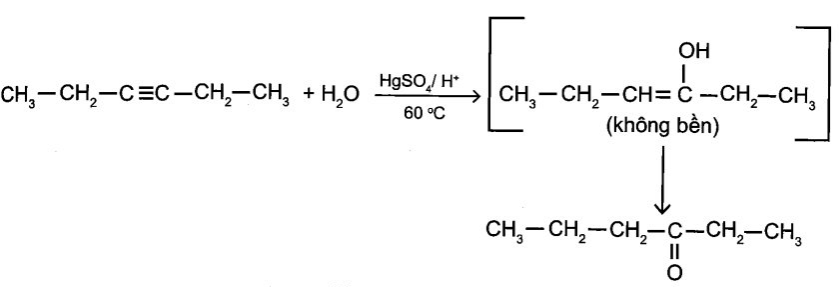
g)
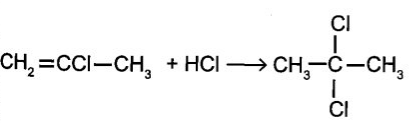
Câu 12:
14/07/2024Khi cho ethylene phản ứng với nước bromine, bên cạnh sản phẩm 1,2-dibromoethane, người ta còn thu được sản phẩm 2-bromoethanol có công thức như sau: HO-CH2-CH2-Br
Viết phương trình phản ứng minh hoạ.
 Xem đáp án
Xem đáp án
Phương trình hóa học của phản ứng:
CH2=CH2 + Br2 + H2O → HO-CH2-CH2-Br + HBr
Câu 13:
22/07/2024Khi tiến hành cho phân tử alkene cộng nước cần xúc tác là acid, sản phẩm thu được là alcohol. Nhiệt độ cần thiết cho phản ứng phụ thuộc vào bậc của alcohol tạo thành. Alcohol bậc III chỉ cần nhiệt độ dưới 25 °C, alcohol bậc II cần nhiệt độ dưới 100 °C và alcohol bậc I cần nhiệt độ dưới 170 °C. Viết các phương trình phản ứng sau (chỉ viết sản phẩm chính):
a) CH2=CH2 + H2O
b) CH3-CH2-CH = CH2 + H2O
c) CH3-CH=C(CH3)-CH3 + H2O
 Xem đáp án
Xem đáp án
a) CH2=CH2 + H2O C2H5OH
b) CH3-CH2-CH = CH2 + H2O CH3-CH2-CH(OH)-CH3
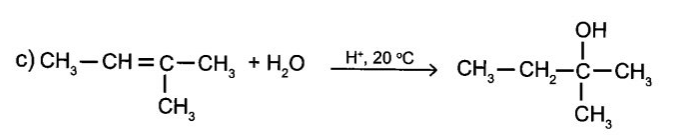
Câu 14:
16/07/2024 Xem đáp án
Xem đáp án
Thuốc thử để phân biệt 2 chất lỏng mất nhãn gồm hexane và hex-1-ene là nước bromine. Tuy nhiên cũng có thể dựa vào phổ hồng ngoại của chúng để phân biệt như sau:
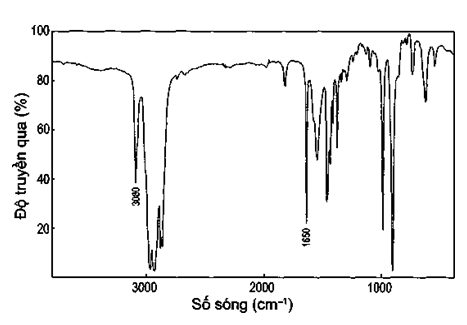
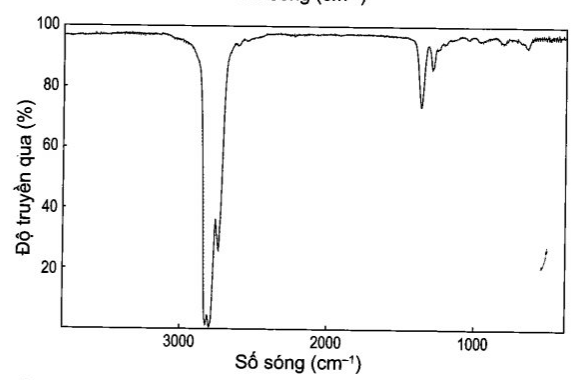
Trong phổ IR của hex-1-ene có peak khoảng 1 650 cm-1 vì đặc trưng cho liên kết đôi C=C nên có thể dễ dàng nhận ra hex-1-ene. Ngoài ra, hex-1-ene có nhóm vinyl (CH2=CH-) nên cũng phải có peak đặc trưng khoảng 3 080 cm-1. Trong khi đó, phổ IR của hexane không có các peak này nên có thể dễ dàng phân biệt chúng.
Câu 15:
20/07/2024a) Đề nghị phương pháp hoá học phân biệt 2 chất lỏng mất nhãn là hex-1-yne và hex-2-yne.
b) Trình bày phương pháp vật lí phân biệt 2 chất lỏng mất nhãn trên.
 Xem đáp án
Xem đáp án
a) Có thể dùng dung dịch AgNO3 trong NH3 để phân biệt chúng theo phương pháp hoá học.
b) Phương pháp vật lí là dùng phổ hồng ngoại để phân biệt. Đặc trưng phổ hồng ngoại của các alk-1-yne là có peak khoảng 3 300 cm-1, trong khi các alkyne khác không có peak này. Do đó phổ hồng ngoại có peak đặc trưng khoảng 3 300 cm-1 là hex-1 -yne. Chất còn lại là hex-2-yne.
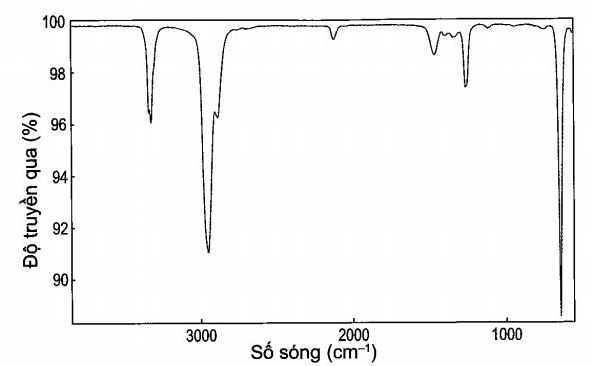
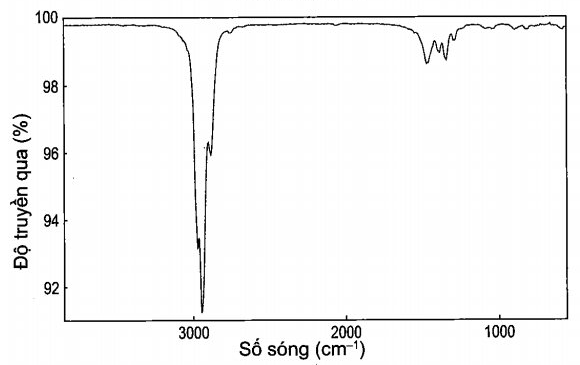
Câu 16:
14/07/2024a) Vì sao nguyên tử carbon ở trạng thái lai hoá sp (trong liên kết ba C≡C) có độ âm điện lớn hơn nguyên tử carbon ở trạng thái lai hoá sp2 (trong liên kết đôi C=C) và nguyên tử carbon ở trạng thái lai hoá sp3 (trong liên kết đơn C-C)? Điều này ảnh hưởng gì đến độ linh động của các nguyên tử hydrogen liên kết trực tiếp với các nguyên tử carbon ở các trạng thái lai hoá trên?
b) Nêu công thức cấu tạo một hydrocarbon bất kì có chứa 3 nguyên tử hydrogen linh động trong phân tử.
 Xem đáp án
Xem đáp án
a) Nguyên tử carbon ở trạng thái lai hoá sp có tỉ lệ đóng góp của orbital s là 50%, cao hơn so với nguyên tử carbon ở trạng thái lai hoá sp2 (33,3%) và nguyên tử carbon ở trạng thái lai hoá sp3 (25%) nên orbital lai hoá sp của nguyên tử carbon ở gần hạt nhân hơn, dẫn đến nguyên tử carbon lai hoá sp có độ âm điện cao hơn. Vì thế nguyên tử hydrogen liên kết trực tiếp với các nguyên tử carbon mang liên kết ba có tính linh động.
b) Hydrocarbon có 3 nguyên tử hydrogen linh động có thể là:
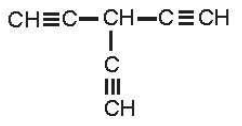
Câu 17:
12/07/2024Dẫn 150 gam acetylene qua ống sắt nóng đỏ thu được 90 gam benzene. Viết phương trình phản ứng xảy ra và tính hiệu suất phản ứng.
 Xem đáp án
Xem đáp án
Phương trình phản ứng xảy ra: 3CH≡CH C6H6
Với 150 gam acetylene, trên lí thuyết phải thu được 150 gam benzene nhưng thực tế chỉ thu được 90 gam benzene nên hiệu suất phản ứng đạtCâu 18:
23/07/2024Có một số loại trái cây chưa chín mà chúng ta lại muốn được sớm thưởng thức chúng, chẳng hạn một quả bơ, xoài, ... Có một cách giải quyết đơn giản là cho quả bơ vào túi giấy cùng với vài quả chuối, bơ sẽ chín nhanh hơn nhiều. Giải thích cách làm trên.
 Xem đáp án
Xem đáp án
Đó là do chuối khi chuẩn bị chín sẽ giải phóng một loại hormone thực vật ở thể khí là ethylene, giúp đẩy nhanh quá trình chín không những của chuối mà còn nhiều loại quả khác nhau. Nhờ đó quả bơ cũng được đẩy nhanh chín theo.
Câu 19:
18/07/2024Nhu cầu sử dụng PVC trên toàn thế giới liên tục tăng trong các năm qua.
Để thu được PVC, cần đi từ monomer là vinyl chloride. Có thể điều chế vinyl chloride từ acetylene hoặc ethylene. Một trong những cách điều chế vinyl chloride từ ethylene hiện nay là theo sơ đồ:
Viết các phương trình phản ứng minh hoạ.
 Xem đáp án
Xem đáp án
Các phương trình phản ứng xảy ra:
CH2 = CH2 + Cl2 → CH2Cl - CH2Cl
CH2Cl - CH2Cl + KOH CH2 = CH - Cl + KCl + H2O
Câu 20:
22/07/2024Vinyl acetate có công thức CH3COOCH=CH2, là một ester được dùng nhiều trong lĩnh vực sản xuất keo, sơn, làm chất nhũ hoá các sản phẩm như súp, nước sốt,... Vinyl acetate được điều chế từ hỗn hợp gồm acetic acid, ethylene và oxygen dưới sự có mặt của xúc tác palladium ở 175 °C- 200 °C và áp suất 5 bar - 9 bar. Viết phương trình phản ứng minh hoạ điều chế vinyl acetate.
 Xem đáp án
Xem đáp án
Phương trình phản ứng xảy ra:
2CH3COOH + CH2=CH2 + 2O2 CH3COOCH=CH2 + H2O
Câu 21:
19/07/2024Ngày nay, các nhà máy thường sử dụng chu trình khép kín hoặc tích hợp các phương pháp để nâng cao hiệu suất, hạ giá thành sản phẩm, đồng thời giảm thiểu ô nhiễm môi trường. Viết các phương trình phản ứng biểu diễn sơ đồ sản xuất sau và cho biết sơ đồ nào là tích hợp các phương pháp sản xuất vinyl chloride? Sơ đồ nào thải sản phẩm phụ ra môi trường?
a)
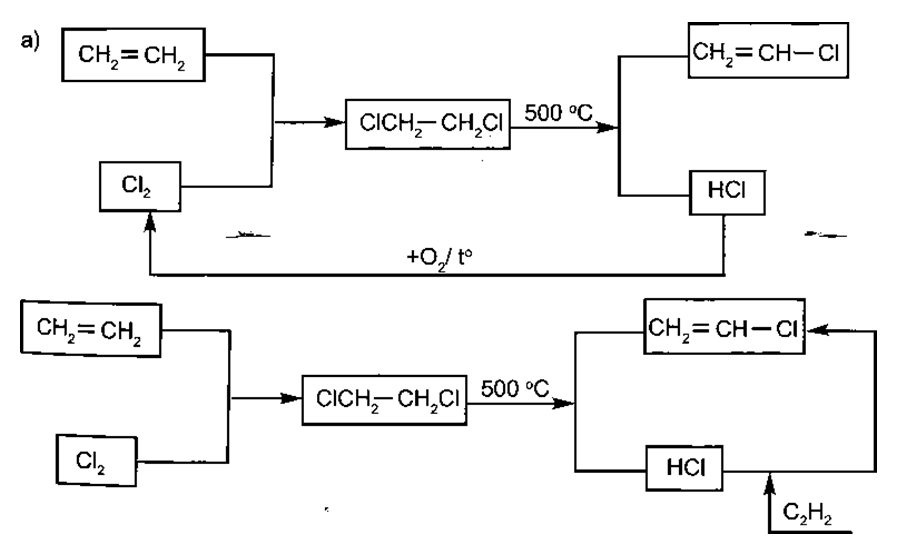
 Xem đáp án
Xem đáp án
a) CH2 = CH2 + Cl2→ CH2Cl - CH2Cl
CH2Cl - CH2Cl + KOH CH2 = CH - Cl + KCl + H2O
4HCl + O2 2Cl2 + 2H2O
b) CH2 =CH2+Cl2 → CH2Cl-CH2Cl
CH2Cl - CH2Cl CH2 = CH - Cl + HCl
CH = CH + HCl CH2 = CHCl
Sơ đồ b) tích hợp các phương pháp sản xuất vinyl chloride, còn sơ đồ a) thải sản phẩm phụ là H2O ra môi trường.
