Giải SBT Hóa 11 CTST Bài 7: Sulfuric acid và muối sulfate
Giải SBT Hóa 11 CTST Bài 7: Sulfuric acid và muối sulfate
-
271 lượt thi
-
17 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
15/07/2024Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cu là kim loại hoạt động yếu nên không phản ứng với dung dịch H2SO4 loãng.
Câu 2:
22/07/2024Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Các kim loại Al, Fe thụ động trong H2SO4 đặc nguội.
Các kim loại Au, Pt có tính khử yếu nên không phản ứng với dung dịch H2SO4 đặc nguội.
Câu 3:
21/07/2024Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính chất hoá học nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dung dịch sulfuric acid đặc còn có tính oxi hóa mạnh còn H2SO4 loãng chỉ có tính acid.
Câu 4:
23/07/2024Cách pha loãng dung dịch H2SO4 đặc nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi sulfuric acid tan vào nước sẽ tỏa ra một nhiệt lượng lớn. Sulfuric acid đặc giống như dầu và nặng hơn trong nước. Nếu bạn cho nước vào acid, nước sẽ nổi trên bề mặt acid. Tại vị trí nước tiếp xúc với acid nhiệt độ cao làm cho nước sôi mãnh liệt và bắn tung tóe gây nguy hiểm.
Nên rót từ từ acid vào nước và khuấy đều để nhiệt lượng tỏa ra từ từ không gây hại cho người thực hiện.
Câu 5:
19/07/2024Người ta thường dùng các bình bằng thép để đựng và chuyên chở dung dịch H2SO4 đặc vì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Người ta thường dùng các bình bằng thép để đựng và chuyên chở dung dịch H2SO4 đặc vì dung dịch H2SO4 đặc bị không phản ứng với sắt ở nhiệt độ thường.
Câu 6:
22/07/2024Hỗn hợp (X) gồm Mg và Fe2O3 có khối lượng 20 gam tan hết trong dung dịch H2SO4 loãng thoát ra a L khí H2 (đkc) và tạo thành dung dịch (Y). Thêm dung dịch NaOH dư vào dung dịch (Y) và lọc kết tủa, tách ra nung đến khối lượng không đổi thu được 28 gam chất rắn. Phần trăm khối lượng Mg trong hỗn hợp (X) là
Câu 7:
16/07/2024Bình đựng dung dịch H2SO4 đặc để trong không khí ẩm lâu ngày thì khối lượng bình có thay đổi không? Vì sao?
 Xem đáp án
Xem đáp án
Khối lượng bình tăng lên do H2SO4 đặc hút nước trong không khí ẩm.
Câu 9:
19/07/2024Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Trong công nghiệp, sulfuric acid được sản xuất bằng phương pháp tiếp xúc. Phương pháp này gồm 3 công đoạn chính: sản xuất SO2 → sản xuất SO3 → sản xuất H2SO4. Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng thích hợp. Hãy cho biết điều kiện của phản ứng trên là gì? Biết rằng trong tự nhiên cũng có một lượng sulfuric acid sinh ra theo các công đoạn trên. Hãy giải thích quá trình hình thành
 Xem đáp án
Xem đáp án
Điều kiện phản ứng là: nhiệt độ 450 °C - 500 °C, xúc tác là vanadium(V) oxide (V2O5).
Trong tự nhiên cũng xảy ra quá trình sản xuất sulfuric acid theo các công đoạn trên vì: SO2 là sản phẩm phụ chiếm một lượng lớn trong công nghiệp luyện kim màu, SO2 tiếp tục kết hợp với O2 trong không khí tạo SO3 nhờ chất xúc tác là các oxide kim loại có trong khói bụi khí thải, SO3 kết hợp với nước tạo H2SO4.
Câu 10:
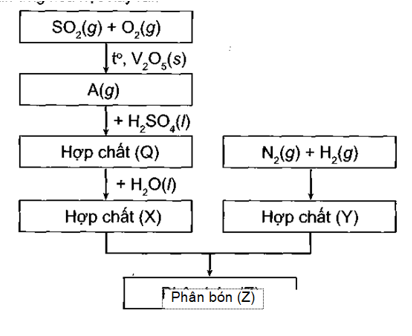
22/07/2024Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất phân bón (Z). Hãy xác định các chất (A), (Q), (X), (Y), (Z). Viết các phản ứng hóa học xảy ra.
 Xem đáp án
Xem đáp án
Các phản ứng hóa học xảy ra là:
2SO2 + O2 2SO3 (A)
nSO3 + H2SO4 → H2SO4.nSO3 (Q)
H2SO4.nSO3 + nH2O → (n + 1)H2SO4 (X)
N2 + 3H2 2NH3 (Y)
H2SO4 + 2NH3 → (NH4)2SO4 (Z)
Câu 11:
20/07/2024Cho các dung dịch không màu của mỗi chất sau đây chứa trong các lọ mất nhãn riêng biệt: Na2CO3, MgSO4, KNO3, NaOH, HCl. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
 Xem đáp án
Xem đáp án
- Trích mẫu thử, sử dụng thuốc thử, kết quả thu được theo như bảng:
|
|
Na2CO3 |
MgSO4 |
KNO3 |
NaOH |
HCl |
||||
|
HCl |
sủi bọt khí |
— |
— |
— |
— |
||||
|
BaCl2 |
— |
kết tủa trắng |
— |
— |
— |
||||
|
Quỳ tím |
— |
— |
— |
xanh |
đỏ |
Câu 12:
22/07/2024Đặt hai cốc (A) và (B) có khối lượng bằng nhau lên hai đĩa cân thấy cân thăng bằng. Cho 15,9 gam Na2CO3 vào cốc (A) và 17,73 gam CaCO3 vào cốc (B), sau đó thêm 18 gam dung dịch H2SO4 98% vào cốc (A) và m gam dung dịch HCl14,6% vào cốc (B) thì thấy cân thăng bằng. Tính khối lượng dung dịch HCl đã cho vào cốc (B).
 Xem đáp án
Xem đáp án
Từ đề bài, ta có: ;
Xét cốc (A): Na2CO3 + H2SO4 → Na2SO4 + CO2 ↑ + H2O
H2SO4 dư, tính theo Na2CO3
Sau phản ứng: ∆mcốcA= 15,9 + 18 - 0,15.44 = 27,3 (g).
Xét cốc (B): 2HCl + CaCO3 → CaCl2 + CO2 + H2O
Giả thiết nếu CaCO3 tan hết
∆mcốcB ≥ 17,73 + 88,65 - 0,1773.44 = 98,5788 (g) ( > 27,3 g) Sai với đề, do đó để cân bằng thì CaCO3 phải dư.
Đặt số mol HCl = y =0,5y (mol).
17,73 + 250y – 0,5y.44 = 27,3 y ≈ 0,042 (mol).
Câu 13:
22/07/2024Đặt hai cốc (A), (B) có cùng khối lượng lên hai đĩa cân thấy cân thăng bằng. Cho vào cốc (A) 102 gam AgNO3 dạng rắn; cốc (B) 124,2 gam K2CO3 dạng rắn.
a) Thêm 100 gam dung dịch HCI 29,2% vào cốc (Á); 100 gam dung dịch H2SO4 24,5% vào cốc (B). Phải thêm bao nhiêu gam nước vào cốc (A) (hay cốc B) để cân trở lại thăng bằng?
 Xem đáp án
Xem đáp án
a) Xét cốc (A): AgNO3 + HCl → AgCl↓ + HNO3
Theo đề ta có: .
mHCl = 100.29,2% = 29,2 (g) nHCl = 0,8 (mol).
nHCl = 0,8 > HCl dư, tính theo AgNO3
mA (sau phản ứng) = + mdd HCl = 102 + 100 = 202 (g).
Xét cốc (B): K2CO3 + H2SO4 → K2SO4 + H2O + CO2 ↑
Theo đề bài ta có: = 0,9 (mol).
= 0,9 > K2CO3 dư, tính theo H2SO4.
Áp dụng định luật bảo toàn khối lượng:
= + mdung dịch sau phản ứng
mdung dịch sau phản ứng = 124,2 + 100 – 0,25.44 = 213,2 (g)
mB > mA Khối lượng H2O thêm vào cốc (A) = 213,2 - 202 = 11,2 (g)
Câu 14:
09/07/2024b) Sau khi cân đã thăng bằng, lấy một nửa lượng dung dịch có trong cốc (A) cho vào cốc (B). Sau phản ứng, phải thêm bao nhiêu gam nước vào cốc (A) để cân trở lại thăng bằng?
 Xem đáp án
Xem đáp án
b) Cốc (A) nặng 213,2 g, bao gồm phần rắn AgCl (0,6.143,5 = 86,1 g) và phần dung dịch (213,2 - 86,1 = 127,1 g)
Khối lượng dung dịch 1/2 cốc (A) =
Ở 1/2 cốc (A) chứa 0,1 mol HCl và 0,3 mol HNO3 tạo thành.
HCl → H+ + Cl- HNO3 → H+ + NO3-
0,1 → 0,1 mol 0,3 0,3 mol
Ở cốc (B) còn 0,65 mol K2CO3 và 0,25 mol K2SO4 tác dụng với HCl trong cốc (A).
K2CO3 + 2HCl → 2KCl + CO2↑ + H2O
K2CO3 + 2HNO3 → 2KNO3 + CO2↑ + H2O
Hay CO32- + 2H+ → CO2↑ + H2O
mB = ![]() mdd A + mdd B - =
mdd A + mdd B - =
Khối lượng nước thêm vào cốc (A) = 267,95 - (. 127,1 + 86,1) = 118,3 (g)
Câu 16:
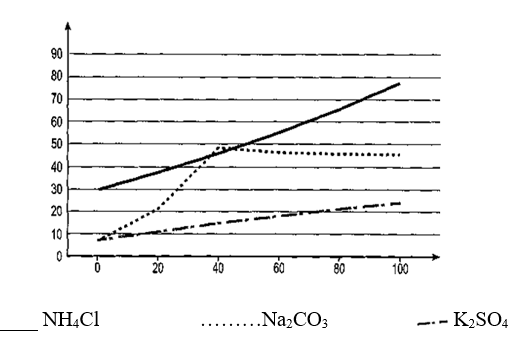
19/07/2024b) Độ tan của các chất rắn trong nước thường tăng theo nhiệt độ. Có nhận xét gì về độ tan của ba chất? Chất có độ tan lớn là ở nhiệt độ nào?
 Xem đáp án
Xem đáp án
b) Độ tan của các muối tăng theo nhiệt độ. Trong đó, độ tan của NH4Cl tăng nhanh, độ tan của K2SO4 tăng chậm khi nhiệt độ tăng.
Độ tan của muối Na2CO3 tăng khi nhiệt độ tăng đến khoảng 40 °C. Sau đó độ tan của Na2CO3 lại bị giảm khi nhiệt độ tăng từ 40 °C đến 100 °C.
Chất có độ tan lớn nhất là NH4Cl, ở nhiệt độ 100 °C có độ tan là 77,30 g/100 g H2OCâu 17:
10/07/2024c) Chất nào có độ tan lớn nhất ở 30 °C và 90 °C?
 Xem đáp án
Xem đáp án
c) Chất có độ tan lớn nhất: ở 30 °C là NH4Cl, ở 90 °C là NH4Cl.