Câu hỏi:
22/07/2024 261
Đặt hai cốc (A), (B) có cùng khối lượng lên hai đĩa cân thấy cân thăng bằng. Cho vào cốc (A) 102 gam AgNO3 dạng rắn; cốc (B) 124,2 gam K2CO3 dạng rắn.
a) Thêm 100 gam dung dịch HCI 29,2% vào cốc (Á); 100 gam dung dịch H2SO4 24,5% vào cốc (B). Phải thêm bao nhiêu gam nước vào cốc (A) (hay cốc B) để cân trở lại thăng bằng?
Đặt hai cốc (A), (B) có cùng khối lượng lên hai đĩa cân thấy cân thăng bằng. Cho vào cốc (A) 102 gam AgNO3 dạng rắn; cốc (B) 124,2 gam K2CO3 dạng rắn.
a) Thêm 100 gam dung dịch HCI 29,2% vào cốc (Á); 100 gam dung dịch H2SO4 24,5% vào cốc (B). Phải thêm bao nhiêu gam nước vào cốc (A) (hay cốc B) để cân trở lại thăng bằng?
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
a) Xét cốc (A): AgNO3 + HCl → AgCl↓ + HNO3
Theo đề ta có: .
mHCl = 100.29,2% = 29,2 (g) nHCl = 0,8 (mol).
nHCl = 0,8 > HCl dư, tính theo AgNO3
mA (sau phản ứng) = + mdd HCl = 102 + 100 = 202 (g).
Xét cốc (B): K2CO3 + H2SO4 → K2SO4 + H2O + CO2 ↑
Theo đề bài ta có: = 0,9 (mol).
= 0,9 > K2CO3 dư, tính theo H2SO4.
Áp dụng định luật bảo toàn khối lượng:
= + mdung dịch sau phản ứng
mdung dịch sau phản ứng = 124,2 + 100 – 0,25.44 = 213,2 (g)
mB > mA Khối lượng H2O thêm vào cốc (A) = 213,2 - 202 = 11,2 (g)
a) Xét cốc (A): AgNO3 + HCl → AgCl↓ + HNO3
Theo đề ta có: .
mHCl = 100.29,2% = 29,2 (g) nHCl = 0,8 (mol).
nHCl = 0,8 > HCl dư, tính theo AgNO3
mA (sau phản ứng) = + mdd HCl = 102 + 100 = 202 (g).
Xét cốc (B): K2CO3 + H2SO4 → K2SO4 + H2O + CO2 ↑
Theo đề bài ta có: = 0,9 (mol).
= 0,9 > K2CO3 dư, tính theo H2SO4.
Áp dụng định luật bảo toàn khối lượng:
= + mdung dịch sau phản ứng
mdung dịch sau phản ứng = 124,2 + 100 – 0,25.44 = 213,2 (g)
mB > mA Khối lượng H2O thêm vào cốc (A) = 213,2 - 202 = 11,2 (g)
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Người ta thường dùng các bình bằng thép để đựng và chuyên chở dung dịch H2SO4 đặc vì
Người ta thường dùng các bình bằng thép để đựng và chuyên chở dung dịch H2SO4 đặc vì
Câu 2:
Trong lúc làm thí nghiệm, do bất cẩn nên một học sinh bị dung dịch H2SO4 đặc rơi lên tay. Hãy nêu biện pháp xử lí trong tình huống này trước khi đưa học sinh đến cơ sở y tế gần nhất.
Trong lúc làm thí nghiệm, do bất cẩn nên một học sinh bị dung dịch H2SO4 đặc rơi lên tay. Hãy nêu biện pháp xử lí trong tình huống này trước khi đưa học sinh đến cơ sở y tế gần nhất.
Câu 3:
Đặt hai cốc (A) và (B) có khối lượng bằng nhau lên hai đĩa cân thấy cân thăng bằng. Cho 15,9 gam Na2CO3 vào cốc (A) và 17,73 gam CaCO3 vào cốc (B), sau đó thêm 18 gam dung dịch H2SO4 98% vào cốc (A) và m gam dung dịch HCl14,6% vào cốc (B) thì thấy cân thăng bằng. Tính khối lượng dung dịch HCl đã cho vào cốc (B).
Đặt hai cốc (A) và (B) có khối lượng bằng nhau lên hai đĩa cân thấy cân thăng bằng. Cho 15,9 gam Na2CO3 vào cốc (A) và 17,73 gam CaCO3 vào cốc (B), sau đó thêm 18 gam dung dịch H2SO4 98% vào cốc (A) và m gam dung dịch HCl14,6% vào cốc (B) thì thấy cân thăng bằng. Tính khối lượng dung dịch HCl đã cho vào cốc (B).
Câu 4:
Hỗn hợp (X) gồm Mg và Fe2O3 có khối lượng 20 gam tan hết trong dung dịch H2SO4 loãng thoát ra a L khí H2 (đkc) và tạo thành dung dịch (Y). Thêm dung dịch NaOH dư vào dung dịch (Y) và lọc kết tủa, tách ra nung đến khối lượng không đổi thu được 28 gam chất rắn. Phần trăm khối lượng Mg trong hỗn hợp (X) là
Hỗn hợp (X) gồm Mg và Fe2O3 có khối lượng 20 gam tan hết trong dung dịch H2SO4 loãng thoát ra a L khí H2 (đkc) và tạo thành dung dịch (Y). Thêm dung dịch NaOH dư vào dung dịch (Y) và lọc kết tủa, tách ra nung đến khối lượng không đổi thu được 28 gam chất rắn. Phần trăm khối lượng Mg trong hỗn hợp (X) là
Câu 5:
Cho các dung dịch không màu của mỗi chất sau đây chứa trong các lọ mất nhãn riêng biệt: Na2CO3, MgSO4, KNO3, NaOH, HCl. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
Cho các dung dịch không màu của mỗi chất sau đây chứa trong các lọ mất nhãn riêng biệt: Na2CO3, MgSO4, KNO3, NaOH, HCl. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
Câu 6:
Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính chất hoá học nào?
Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính chất hoá học nào?
Câu 7:
Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất phân bón (Z). Hãy xác định các chất (A), (Q), (X), (Y), (Z). Viết các phản ứng hóa học xảy ra.
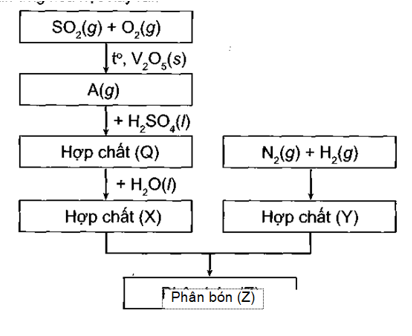
Câu 8:
Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
Câu 9:
Bảng dưới đây cho biết độ tan của ba muối trong nước ở những nhiệt độ khác nhau:
Nhiệt độ của Nước (°C)
Độ tan (gam/100 gam nước)
Na2CO3
NH4Cl
K2SO4
0
7,10
29,70
7,33
20
21,40
37,56
11,11
40
48,50
46,00
14,97
60
46,50
55,30
18,20
80
45,80
65,60
21,29
100
45,50
77,30
24,10
a) Vẽ đồ thị biểu diễn độ tan của ba muối theo nhiệt độ.
Bảng dưới đây cho biết độ tan của ba muối trong nước ở những nhiệt độ khác nhau:
|
Nhiệt độ của Nước (°C) |
Độ tan (gam/100 gam nước) |
||
|
Na2CO3 |
NH4Cl |
K2SO4 |
|
|
0 |
7,10 |
29,70 |
7,33 |
|
20 |
21,40 |
37,56 |
11,11 |
|
40 |
48,50 |
46,00 |
14,97 |
|
60 |
46,50 |
55,30 |
18,20 |
|
80 |
45,80 |
65,60 |
21,29 |
|
100 |
45,50 |
77,30 |
24,10 |
a) Vẽ đồ thị biểu diễn độ tan của ba muối theo nhiệt độ.
Câu 11:
Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Trong công nghiệp, sulfuric acid được sản xuất bằng phương pháp tiếp xúc. Phương pháp này gồm 3 công đoạn chính: sản xuất SO2 → sản xuất SO3 → sản xuất H2SO4. Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng thích hợp. Hãy cho biết điều kiện của phản ứng trên là gì? Biết rằng trong tự nhiên cũng có một lượng sulfuric acid sinh ra theo các công đoạn trên. Hãy giải thích quá trình hình thành
Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Trong công nghiệp, sulfuric acid được sản xuất bằng phương pháp tiếp xúc. Phương pháp này gồm 3 công đoạn chính: sản xuất SO2 → sản xuất SO3 → sản xuất H2SO4. Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng thích hợp. Hãy cho biết điều kiện của phản ứng trên là gì? Biết rằng trong tự nhiên cũng có một lượng sulfuric acid sinh ra theo các công đoạn trên. Hãy giải thích quá trình hình thành
Câu 12:
Bình đựng dung dịch H2SO4 đặc để trong không khí ẩm lâu ngày thì khối lượng bình có thay đổi không? Vì sao?
Bình đựng dung dịch H2SO4 đặc để trong không khí ẩm lâu ngày thì khối lượng bình có thay đổi không? Vì sao?
Câu 13:
b) Sau khi cân đã thăng bằng, lấy một nửa lượng dung dịch có trong cốc (A) cho vào cốc (B). Sau phản ứng, phải thêm bao nhiêu gam nước vào cốc (A) để cân trở lại thăng bằng?
b) Sau khi cân đã thăng bằng, lấy một nửa lượng dung dịch có trong cốc (A) cho vào cốc (B). Sau phản ứng, phải thêm bao nhiêu gam nước vào cốc (A) để cân trở lại thăng bằng?
Câu 14:
b) Độ tan của các chất rắn trong nước thường tăng theo nhiệt độ. Có nhận xét gì về độ tan của ba chất? Chất có độ tan lớn là ở nhiệt độ nào?
b) Độ tan của các chất rắn trong nước thường tăng theo nhiệt độ. Có nhận xét gì về độ tan của ba chất? Chất có độ tan lớn là ở nhiệt độ nào?


