Giải SBT Hóa 10 Bài 17: Nguyên tố và đơn chất halogen có đáp án
Giải SBT Hóa 10 Bài 17: Nguyên tố và đơn chất halogen có đáp án
-
217 lượt thi
-
34 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
18/07/2024Phát biểu nào sau đây không đúng khi nói về nguyên tử các nguyên tố nhóm VIIA?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu D không đúng vì: Trong nhóm VIIA, theo chiều tăng dần điện tích hạt nhân nguyên tử thì bán kính nguyên tử tăng.
Câu 2:
20/07/2024a) Điền tên và kí hiệu các nguyên tố halogen bền vào vị trí các nguyên tố A, B, C, D bên dưới. Biết mỗi vòng tròn minh họa cho một nguyên tử với tỉ lệ kích thước tương ứng.
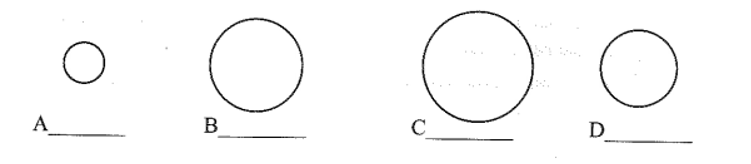
 Xem đáp án
Xem đáp án
a) Từ fluorine đến iodine bán kính nguyên tử tăng dần. Ta có kết quả điền như sau:
A: Fluorine, F;
B: Bromine, Br;
C: Iodine, I;
D: Chlorine, Cl.
Câu 3:
20/07/2024b) Viết công thức phân tử đơn chất của mỗi nguyên tố tương ứng.
 Xem đáp án
Xem đáp án
b) Công thức phân tử đơn chất của mỗi nguyên tố tương ứng:
A: Fluorine, F2;
B: Bromine, Br2;
C: Iodine, I2;
D: Chlorine, Cl2.
Câu 4:
13/07/2024c) Ở điều kiện nhiệt độ, áp suất thông thường, các đơn chất này tồn tại ở trạng thái nào? Từ đó, dự đoán thứ tự tăng nhiệt độ nóng chảy, nhiệt độ sôi tương ứng giữa chúng trong cùng điều kiện áp suất.
 Xem đáp án
Xem đáp án
c) Trạng thái các đơn chất ở điều kiện nhiệt độ, áp suất thông thường:
|
Đơn chất |
F2 |
Cl2 |
Br2 |
I2 |
|
Trạng thái |
Khí |
Khí |
Lỏng |
Rắn |
Từ trạng thái này dự đoán nhiệt độ nóng chảy, nhiệt độ sôi của các halogen tăng dần theo thứ tự: F2, Cl2, Br2, I2.
Câu 5:
23/07/2024Nguyên nhân dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine,
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên nhân dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine, khối lượng phân tử và tương tác van der Waals đều tăng.
Câu 6:
18/07/2024Phát biểu nào sau đây là không đúng khi nói về đơn chất nhóm VIIA?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu D không đúng vì: Khả năng phản ứng với nước giảm từ fluorine đến iodine.
Câu 7:
19/07/2024Những phát biểu nào sau đây là đúng khi nói về tính chất và phản ứng của đơn chất nhóm VIIA?
A. Tính oxi hoá giảm dần từ fluorine đến iodine.
B. Phản ứng với nhiều kim loại, tạo thành hợp chất ion. Phản ứng với một số phi kim, tạo thành hợp chất cộng hoá trị.
C. Khi phản ứng với đơn chất hydrogen, các đơn chất nhóm VIIA thể hiện tính khử.
D. Khi phản ứng với đơn chất hydrogen, mức độ phản ứng giảm dần từ fluorine đến iodine.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A, B, D
Phát biểu C sai vì: Khi phản ứng với đơn chất hydrogen, các đơn chất nhóm VIIA thể hiện tính oxi hóa.
Câu 8:
23/07/2024Nối mỗi chất trong cột A với những tính chất tương ứng của chúng trong cột B.
|
Cột A |
Cột B |
|
a) Chlorine, Cl2 b) Iodine, I2 |
1. Hầu như không tan trong nước. 2. Là chất khí ở điều kiện thường. 3. Là chất rắn ở điều kiện thường. 4. Là chất oxi hoá khi phản ứng với kim loại. 5. Có độc tính cao. 6. Có tương tác van der Waals mạnh nhất trong nhóm đơn chất halogen. 7. Dùng để xử lí nước sinh hoạt. |
 Xem đáp án
Xem đáp án
- a ghép với 2, 4, 5, 7
a) Chlorine, Cl2:
2. Là chất khí ở điều kiện thường.
4. Là chất oxi hoá khi phản ứng với kim loại.
5. Có độc tính cao.
7. Dùng để xử lí nước sinh hoạt.
- b ghép với 1, 3, 4, 6
b) Iodine, I2:
1. Hầu như không tan trong nước.
3. Là chất rắn ở điều kiện thường.
4. Là chất oxi hoá khi phản ứng với kim loại.
6. Có tương tác van der Waals mạnh nhất trong nhóm đơn chất halogen.
Câu 9:
20/07/2024Những phát biểu nào sau đây là đúng khi nói về phản ứng của đơn chất halogen với hydrogen?
A. Các phản ứng đều phát nhiệt mạnh và kèm hiện tượng nổ.
B. Phản ứng giữa fluorine với hydrogen diễn ra mãnh liệt nhất.
C. Điều kiện và mức độ phản ứng phù hợp với xu hướng giảm dần tính oxi hóa từ fluorine đến iodine.
D. Do hợp chất hydrogen iodide sinh ra kém bền (giá trị năng lượng liên kết nhỏ) nên phản ứng giữa iodine với hydrogen là phản ứng hai chiều.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B, C, D
A sai vì phản ứng giữa H2 và Br2 cần đun nóng, phản ứng diễn ra chậm; phản ứng giữa I2 và H2 cần đun nóng để diễn ra, phản ứng là thuận nghịch.
Câu 10:
18/07/2024Những phát biểu nào sau đây là đúng khi nói về phản ứng của đơn chất nhóm VIIA với nước?
A. Các đơn chất nhóm VIIA vừa thể hiện tính oxi hoá, vừa thể hiện tính khử; mức độ phản ứng giảm dần từ fluorine đến iodine.
B. Fluorine phản ứng rất mạnh với nước tạo dung dịch có tính oxi hoá mạnh, có thể dùng để sát khuẩn.
C. Phản ứng của bromine hoặc chlorine với nước đều là phản ứng thuận nghịch.
D. Iodine tan rất ít và hầu như không phản ứng với nước.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C, D
A sai vì fluorine chỉ thể hiện tính oxi hóa.
B sai vì 2F2 + 2H2O → O2 + 4HF; HF có tính oxi hóa yếu và không được dùng để sát khuẩn.
Câu 11:
14/07/2024Phát biểu nào sau đây là không đúng khi nói về phản ứng của đơn chất nhóm VIIA với dung dịch muối halide?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Bromine không phản ứng với dung dịch sodium fluoride.
Câu 12:
23/07/2024Phát biểu nào sau đây là không đúng khi nói về một số ứng dụng của đơn chất chlorine?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khí chlorine không được sử dụng để trừ sâu trong nông nghiệp.Câu 13:
18/07/2024Những phát biểu nào sau đây là đúng?
A. Đơn chất chlorine có tính oxi hóa mạnh hơn đơn chất bromine và iodine.
B. Tương tác van der Waals của các đơn chất halogen tăng từ fluorine đến iodine đã góp phần làm tăng nhiệt độ sôi của chúng.
C. Thành phần của nước bromine gồm các chất: Br2, H2O, HBr, HBrO.
D. Hóa trị phổ biến của nguyên tố halogen là 1.
E. Đơn chất iodine phản ứng được với nước và với dung dịch sodium bromide.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A, B, C, D
Phát biểu E sai vì iodine hầu như không phản ứng với nước và không phản ứng với dung dịch sodium bromide.
Câu 14:
23/07/2024Nhúng giấy quỳ vào dung dịch nước chlorine thì thấy giấy quỳ chuyển sang màu đỏ. Nhưng ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất. Hãy giải thích hiện tượng này.
 Xem đáp án
Xem đáp án
Dung dịch nước chlorine gồm nước; hydrochloric acid (HCl); hypochlorous acid (HClO) và chlorine.
Nhúng giấy quỳ vào dung dịch nước chlorine thì thấy giấy quỳ chuyển sang màu đỏ do trong dung dịch nước chlorine có chứa các acid.
Nhưng ngay sau đó, màu đỏ trên giấy quỳ sẽ biến mất vì HClO có tính oxi hóa mạnh có thể phá hủy các hợp chất màu.
Câu 15:
15/07/2024Ở các đô thị, khi thay nước cho các bồn nuôi cá cảnh, người ta không cho trực tiếp nước sinh hoạt (nước máy) vào bồn cá. Nước này phải được chứa trong xô, thau, chậu khoảng một ngày rồi mới được cho vào bồn nuôi cá. Hãy giải thích.
 Xem đáp án
Xem đáp án
Nước sinh hoạt (nước máy) có chứa hàm lượng chlorine (trong ngưỡng cho phép với con người). Để đảm bảo sức sống cho cá cảnh, người ta không cho trực tiếp nước sinh hoạt (nước máy) vào bồn cá. Nước này phải được chứa trong xô, thau, chậu khoảng một ngày rồi mới được cho vào bồn nuôi cá nhằm làm giảm lượng chlorine dư trong nước sinh hoạt (chlorine dư phát tán vào không khí).
Câu 16:
21/07/2024Để bảo đảm vệ sinh, nước ở các hồ bơi thường xuyên được xử lý bằng hoá chất. Hãy tìm hiểu và cho biết:
a) Các hoá chất nào thường được sử dụng để xử lí vi khuẩn có trong nước hồ bơi?
 Xem đáp án
Xem đáp án
a) Do khó bảo quản trong vận chuyển và lưu trữ, nước chlorine ít được sử dụng để khử khuẩn nước hồ bơi.
Trong thực tế người ta sử dụng nước Javel hoặc chlorine 70 (Ca(OCl)2 hay Ca(ClO)2, calcium hypochlorite dạng bột, dễ bảo quản, lưu trữ và sử dụng).
Ngoài ra người ta còn sử dụng hóa chất TCCA 90 dạng viên chứa hợp chất trichloroisocyanuric (C3Cl3N3O3).
Câu 17:
22/07/2024b) Nhờ đâu mà các hoá chất ấy giúp xử lý vi khuẩn có trong nước hồ bơi?
 Xem đáp án
Xem đáp án
b) Các hóa chất này giúp khử khuẩn trong nước hồ bơi do cung cấp hàm lượng ion hypochlorite có tính oxi hóa mạnh.
Câu 18:
13/07/2024c) Để bảo đảm an toàn cho người bơi trong hồ, cần lưu ý gì khi sử dụng các hoá chất ấy?
 Xem đáp án
Xem đáp án
c) Để bảo đảm an toàn cho người bơi trong hồ, cần sử dụng hóa chất này theo đúng tỉ lệ nhất định được tính toán kĩ với lượng nước trong hồ và hàm lượng tồn dư các hóa chất này trong nước phải đạt tiêu chuẩn cho phép.
Câu 19:
23/07/2024Thổi một lượng khí chlorine vào dung dịch chứa m gam hai muối bromide của sodium và potassium. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch, khối lượng chất rắn thu được giảm 4,45 gam so với lượng muối trong dung dịch ban đầu. Chọn phát biểu đúng về số mol khí chlorine đã tham gia phản ứng với các muối trên.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phản ứng có thể được viết như sau:
12Cl2(g) + Br−(aq) → 12Br2(l) + Cl−(aq)
Theo đặc điểm của phản ứng: Khi 1 mol hỗn hợp muối (NaBr; KBr) chuyển thành 1 mol hỗn hợp muối (NaCl; KCl) thì khối lượng giảm:
80 – 35,5 = 45,5 (gam)
Theo đề bài: Khối lượng muối trong thí nghiệm đã giảm 4,45 gam.
Vậy nmuối = nCl- phản ứng = 4,4544,5=0,1 (mol)
Nên nCl2=0,12=0,05 mol
Câu 20:
23/07/2024a) Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine (sơ đồ minh hoạ). Chất khí này được làm khô (loại hơi nước) rồi hoá lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hoá chất. Theo em, chất nào sau đây phù hợp để làm khô khí chlorine?
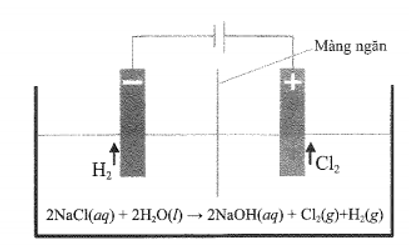
 Xem đáp án
Xem đáp án
a) Đáp án đúng là: A
Chất được dùng làm khô chlorine phải hút được nước và không tác dụng với chlorine.
Vậy sulfuric acid 98% thỏa mãn.
Câu 21:
22/07/2024b) Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (32%, D = 1,153 g mL-1 ở 30oC).
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được bao nhiêu m3 acid thương phẩm trên. Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm đạt 80% về khối lượng.
 Xem đáp án
Xem đáp án
b) Khối lượng acid thương phẩm được tạo ra cùng 200 gam xút:
macid=20040×36,5×60100×80100=87,6 (gam).
Khối lượng dung dịch acid thương phẩm 32% được tạo ra cùng 200 gam xút:
mdd acid=87,6.10032=273,75(gam)
Thể tích dung dịch acid thương phẩm 32% được tạo ra cùng 200 gam xút:
V=mD=273,751,153=237,4(mL)
Vậy với 200 tấn = 200 × 106 gam xút thì lượng acid thương phẩm được tạo thành tương ứng là: 237,4 × 106 (mL) = 237,4 (m3).
Câu 22:
18/07/2024Iodine là chất rắn, ít tan trong nước, nhưng lại tan khá dễ dàng trong dung dịch potassium iodide là do phản ứng sau:
I2 (s) + KI (aq) → KI3 (aq)
Vai trò của KI trong phản ứng trên là gì?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Có thể nhận thấy potassium không thay đổi số oxi hóa (+1 trong các hợp chất).
Số oxi hóa của iodine trong đơn chất và potassium iodide lần lượt là 0 và -1 và giữa chúng không có số oxi hóa trung gian.
Như vậy, trong phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố, do đó không phải là phản ứng oxi hóa – khử.
Thực tế, phản ứng này là sự kết hợp giữa ion I- và phân tử I2 tạo ion I3- bằng một liên kết cho – nhận.
Trong thực tế, phản ứng này giúp chuyển iodine (I2, ít tan trong nước) thành ion triodine (I3-, tan tốt trong nước) phân tán dễ dàng vào dung dịch. Dung dịch này có tính sát khuẩn.
Câu 23:
18/07/2024Calcium chloride hypochlorite (CaOCl2) thường được dùng làm chất khử trùng bể bơi do có tính oxi hóa mạnh tương tự nước Javel. Tìm hiểu thêm về công thức cấu tạo của CaOCl2, từ đó, biết được số oxi hóa của nguyên tử chlorine trong hợp chất trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CaOCl2 là muối hỗn tạp, được tạo nên bởi 1 cation kim loại và 2 anion gốc axit.
Công thức cấu tạo của CaOCl2 là:
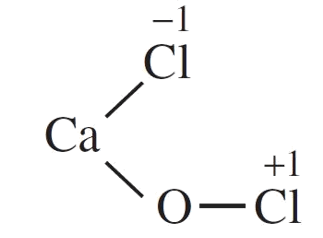
Câu 24:
19/07/2024Xét các phản ứng:
X2(g) + H2(g) → 2HX (g)
với X lần lượt là Cl, Br, I.
Giá trị năng lượng liên kết (kJ mol-1) một số chất được cho trong Phụ lục 2, SGK Hóa học 10, Cánh Diều.
a) Hãy tính biến thiên enthalpy chuẩn của mỗi phản ứng (*).
 Xem đáp án
Xem đáp án
a) Xét các phản ứng:
Biến thiên enthalpy chuẩn được tính theo công thức:
Với phản ứng:
Cl2(g) + H2(g) → 2HCl(g)
= (243 + 436) – 2 × 431 = -183 (kJ)
Với phản ứng:
Br2(g) + H2(g) → 2HBr(g)
= (193 + 436) – 2 × 364 = -99 (kJ).
Với phản ứng:
I2(g) + H2(g) → 2HI(g)
= (151 + 436) – 2 × 297 = -7 (kJ).
Câu 25:
23/07/2024b) Hãy sắp xếp các phản ứng (*) theo thứ tự giảm dần của nhiệt lượng tỏa ra.
 Xem đáp án
Xem đáp án
b) Nhiệt lượng tỏa ra trong phản ứng của Cl2 > Br2 > I2.
Phản ứng có giá trị biến thiên enthalpy chuẩn càng âm thì tỏa nhiệt càng nhiều.
Câu 26:
16/07/2024Từ bảng giá trị năng lượng liên kết (kJ mol-1) dưới đây:

Hãy cho biết:
a) Liên kết nào bền nhất, liên kết nào kém bền nhất?
 Xem đáp án
Xem đáp án
a) Liên kết bền nhất là H – F. Năng lượng liên kết càng lớn thì liên kết càng bền.
Câu 27:
14/07/2024b) Giá trị biến thiên enthalpy chuẩn của hai phản ứng sau là bao nhiêu?
F2(g) + H2(g) → 2HF(g) (1)
O2(g) + 2H2(g) → 2H2O(g) (2)
 Xem đáp án
Xem đáp án
b) F2(g) + H2(g) → 2HF(g) (1)
= 159 + 436 – 2 × 565 = -535 (kJ).
O2(g) + 2H2(g) → 2H2O(g) (2)
= 498 + 2 × 436 – 4 × 464 = -486 (kJ).
Câu 28:
18/07/2024c) Trong hai phản ứng (1) và (2), phản ứng nào tỏa nhiệt nhiều hơn?
 Xem đáp án
Xem đáp án
c) Phản ứng (1) tỏa nhiều nhiệt hơn. Phản ứng có giá trị biến thiên enthalpy chuẩn âm hơn thì sẽ tỏa nhiệt nhiều hơn.
Câu 29:
18/07/2024Người ta thường tách bromine trong rong biển bằng quá trình sục khí chlorine vào dung dịch chiết chứa ion bromide. Phương trình hóa học của phản ứng có thể được mô tả dạng thu gọn như sau:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Cho các số liệu enthalpy tạo thành chuẩn trong bảng dưới đây:

a) Tính biến thiên enthalpy chuẩn phản ứng trên.
 Xem đáp án
Xem đáp án
a) Với phản ứng:
2Br-(aq) + Cl2(aq) → 2Cl-(aq) + Br2(aq)
Dựa vào enthalpy tạo thành chuẩn của các chất, biến thiên enthalpy chuẩn của phản ứng được tính như sau:
= 2 × (-167,16) + (-2,16) – 2 × (-121,55) – (-17,3) = -76,08 (kJ).
Câu 30:
13/07/2024b) Phản ứng trên có thuận lợi về năng lượng không?
 Xem đáp án
Xem đáp án
b) Đây là phản ứng tỏa nhiệt nên thuận lợi về mặt năng lượng. Thực tế phản ứng trên diễn ra dễ dàng.
Câu 31:
21/07/2024Hình sau đây là một phần phổ khối lượng của chlorine. Phổ này có hai tín hiệu, là hai đường thẳng xuất phát từ tọa độ 35 và 37 trên trục hoành. Nhờ đó, người ta biết được nguyên tố chlorine có hai đồng vị bền là 35Cl và 37Cl.
Tỉ lệ số nguyên tử của hai đồng vị cũng là tỉ lệ độ cao h1 và h2 (hay tỉ lệ cường độ tương đối) của hai tín hiệu:
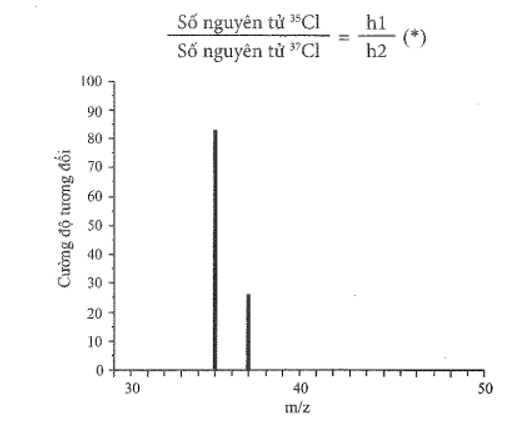
a) Dùng thước (độ chia nhỏ nhất là mm) để đo h1 và h2. Từ đó tính tỉ lệ h1 : h2.
 Xem đáp án
Xem đáp án
a) Dùng thước ta đo được:
h1 = 50 mm; h2 = 15 mm.
Vậy h1 : h2 = 50 : 15 = 10 : 3.
Câu 32:
13/07/2024b) Số nguyên tử đồng vị 35Cl gấp bao nhiêu lần số nguyên tử đồng vị 37Cl?
 Xem đáp án
Xem đáp án
b) Số nguyên tử đồng vị 35Cl gấp lần số nguyên tử đồng vị 37Cl.
Câu 33:
14/07/2024c) Xác định phần trăm số nguyên tử của mỗi đồng vị?
 Xem đáp án
Xem đáp án
c) Phần trăm số nguyên tử của mỗi đồng vị là:
%37Cl = 100% - 76,9% = 23,1%.
Câu 34:
23/07/2024d) Xác định nguyên tử khối trung bình của chlorine.
 Xem đáp án
Xem đáp án
d) Nguyên tử khối trung bình của chlorine là:
