Giải SBT Hóa 10 Bài 12: Liên kết hydrogen và tương tác van der Waals có đáp án
Giải SBT Hóa 10 Bài 12: Liên kết hydrogen và tương tác van der Waals có đáp án
-
81 lượt thi
-
16 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
22/07/2024Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi và nhiệt độ nóng chảy của chất là mạnh hơn ảnh hưởng của tương tác van der Waals.
A sai ví dụ giữa các phân tử HCl không tạo được liên kết hydrogen với nhau.
B sai vì liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
C sai vì liên kết hydrogen chưa phải là loại liên kết yếu nhất giữa các phân tử.
Câu 2:
23/07/2024Cho các phân tử: H2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chỉ có H2O, NH3, HF mới tạo được liên kết hydrogen với các phân tử cùng loại; còn H2S, CO2, HCl thì không.
Câu 3:
17/07/2024Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Thứ tự thể hiện độ mạnh giảm dần của các loại liên kết là:
Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
Câu 4:
20/07/2024Giữa các nguyên tử He có thể có loại liên kết nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Giữa các phân tử không phân cực hoặc giữa các nguyên tử khí hiếm vẫn có thời điểm xuất hiện sự phân cực tạm thời (do nguyên tử chứa các hạt mang điện là proton và electron), do đó luôn có tương tác van der Waals.
Câu 5:
13/07/2024Quy tắc octet không được sử dụng khi xem xét sự hình thành của hai loại liên kết hoặc tương tác nào sau đây?
(1) Liên kết cộng hoá trị.
(2) Liên kết ion.
(3) Liên kết hydrogen.
(4) Tương tác van der Waals.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Quy tắc octet không được sử dụng khi xem xét sự hình thành của:
(3) Liên kết hydrogen.
(4) Tương tác van der Waals.
Chú ý:
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
Câu 6:
21/07/2024Nếu giữa phân tử chất tan và dung môi có thể tạo thành liên kết hydrogen hoặc có tương tác van der Waals càng mạnh với nhau thì càng tan tốt vào nhau.
Lí do nào sau đây là phù hợp để giải thích dầu hoả (thành phần chính là hydrocarbon) không tan trong nước?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dầu hoả (thành phần chính là hydrocarbon) không tan trong nước do nước là phân tử phân cực và dầu là không/ ít phân cực.
Câu 7:
20/07/2024Ethanol tan vô hạn trong nước do
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ethanol tan vô hạn trong nước do nước và ethanol có thể tạo liên kết hydrogen với nhau.
Câu 8:
13/07/2024Chất nào trong số các chất sau tồn tại ở thể lỏng trong điều kiện thường?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CH3OH là chất lỏng ở điều kiện thường do giữa các phân tử CH3OH có thể hình thành liên kết hydrogen.
Câu 9:
21/07/2024Dựa vào liên kết giữa các phân tử, hãy cho biết halogen nào sau đây có nhiệt độ sôi cao nhất.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Do I2 có khối lượng phân tử lớn nhất đồng thời có kích thước lớn nhất nên tương tác van der Waals giữa các phân tử mạnh hơn dẫn đến nhiệt độ sôi cao hơn.
Câu 10:
14/07/2024Hãy giải thích lí do khác nhau về nhiệt độ sôi của các cặp chất có cùng số electron sau đây: CH3 – CH3 (184,5 K) và CH3 – F (194,7 K).
 Xem đáp án
Xem đáp án
Phân tử CH3 – F có tương tác giữa các phân tử mạnh hơn do có liên kết C – F phân cực hơn liên kết C – C trong phân tử CH3 – CH3.
Do đó nhiệt độ sôi của CH3 – F lớn hơn nhiệt độ sôi của CH3 – CH3.
Câu 11:
20/07/2024Ở điều kiện thường, các khí hiếm tồn tại ở dạng khí đơn nguyên tử. Hãy giải thích sự biến đổi nhiệt độ sôi của các khí hiếm từ He tới Rn theo số liệu trong bảng sau:
|
Khí hiếm |
He |
Ne |
Ar |
Kr |
Xn |
Rn |
|
Số hiệu nguyên tử |
2 |
10 |
18 |
36 |
54 |
86 |
|
Nhiệt độ sôi (oC) |
-269 |
-246 |
-186 |
-152 |
-108 |
-62 |
 Xem đáp án
Xem đáp án
Câu 12:
13/07/2024Trong dung dịch, acetic acid có thể tồn tại dạng dimer (hai phân tử kết hợp) do sự hình thành liên kết hydrogen giữa hai phân tử. Hãy vẽ sơ đồ biểu diễn liên kết hydrogen giữa hai phân tử acetic acid hình thành dimer.
 Xem đáp án
Xem đáp án
Sơ đồ biểu diễn liên kết hydrogen giữa hai phân tử acetic acid hình thành dimer:
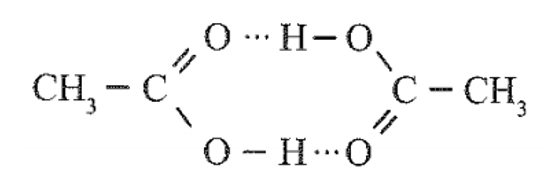
Câu 13:
13/07/2024Hãy giải thích sự biến đổi về nhiệt độ nóng chảy của dãy hydrogen halide sau:
|
Halogen halide |
HF |
HCl |
HBr |
HI |
|
Nhiệt độ nóng chảy (oC) |
-83,1 |
-114,8 |
-88,5 |
-50,8 |
 Xem đáp án
Xem đáp án
- Từ HCl đến HI do kích thước nguyên tử halogen tăng, tương tác van der Waals giữa các phân tử tăng nên nhiệt độ nóng chảy tăng.
- Giữa các phân tử HF có liên kết hydrogen nên nhiệt độ nóng chảy cao hơn so với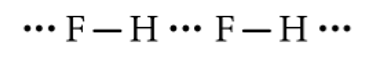
Câu 14:
13/07/2024Nhiệt độ sôi của ba hợp chất được cho trong bảng sau:
|
Hợp chất |
Khối lượng phân tử (g mol-1) |
Nhiệt độ sôi (toC) |
|
2 – hexanone |
100,16 |
128,0 |
|
heptane |
100,20 |
98,0 |
|
1 – hexanol |
102,17 |
156,0 |
Không cần tra cứu cấu trúc, em hãy trả lời các câu hỏi sau về ba hợp chất này:
a) Hợp chất nào có thể hình thành liên kết hydrogen?
 Xem đáp án
Xem đáp án
a) Ba chất có khối lượng phân tử tương đương nhau nên chất có nhiệt độ sôi cao nhất là chất có thể hình thành liên kết hydrogen, đó là 1 – hexanol.
Câu 15:
23/07/2024b) Hợp chất nào phân cực nhưng không hình thành liên kết hydrogen?
 Xem đáp án
Xem đáp án
b) Chất có phân tử phân cực sẽ có tương tác van der Waals giữa các phân tử mạnh hơn, có nhiệt độ sôi xếp thứ hai (ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi là mạnh hơn tương tác van der Waals), do đó chất phân cực là 2 – hexanone.
Câu 16:
19/07/2024c) Hợp chất nào ít phân cực, không hình thành liên kết hydrogen?
 Xem đáp án
Xem đáp án
c) Vậy hợp chất ít phân cực, không hình thành liên kết hydrogen là hợp chất còn lại heptane.
