Đề thi Hóa học 10 Giữa học kì 1 biên soạn
Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 1)
-
450 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
15/07/2024Nguyên tử O (Z = 8) nhận thêm 2e thì cấu hình e tương ứng của nó là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron của Oxi: .
Sau khi O nhận thêm 2e được ion có cấu hình electron là: .
Câu 4:
15/07/2024Cho cấu hình electron của Al (Z = 13): 1s22s22p63s23p1. Hỏi Al thuộc loại nguyên tố gì?
 Xem đáp án
Xem đáp án
Đáp án D
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp p.
Câu 5:
23/07/2024Ở trạng thái cơ bản S (Z = 16) có bao nhiêu electron ở phân lớp ngoài cùng?
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron của S là: → Số electron ở phân lớp ngoài cùng là 4.
Câu 7:
23/07/2024Nguyên tử Na (Z = 11) bị mất đi 1e thì cấu hình e tương ứng của nó là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron của Na là . → Cấu hình electron của Na khi mất 1 electron là: .
Câu 8:
03/07/2024Ở trạng thái cơ bản, cấu hình electron nguyên tử nitơ (Z = 7) có bao nhiêu phân lớp?
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của N là: . Vậy cấu hình electron nguyên tử N gồm 3 phân lớp.
Câu 9:
18/07/2024Nguyên tử Ca (Z = 20) có số e ở lớp ngoài cùng là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron nguyên tử Ca là: . Vậy số e lớp ngoài cùng là 2.
Câu 10:
13/07/2024Nguyên tử X có tổng số hạt proton, nơtron và electron là 115. Ngoài ra số khối của X là 80. Số lớp electron và số electron lớp ngoài của X cùng lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình:
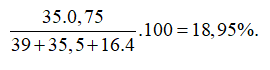
Cấu hình electron nguyên tử X là: . Vậy X có 4 lớp electron và 7electron lớp ngoài cùng.
Câu 11:
14/07/2024Chọn câu phát biểu sai?
 Xem đáp án
Xem đáp án
Đáp án D
Số khối bằng tổng số hạt proton và số nơtron.
Câu 12:
18/07/2024Cho nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử đúng của X là?
 Xem đáp án
Xem đáp án
Đáp án B
Số khối A = 12 + 12 = 24.
Số hiệu nguyên tử Z = số proton = 12.
Kí hiệu nguyên tử là
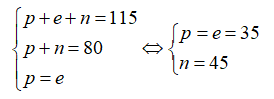
Câu 14:
23/07/2024Cho cấu hình electron của Fe (Z = 26): . Hỏi Fe thuộc loại nguyên tố gì?
 Xem đáp án
Xem đáp án
Đáp án B
Theo trật tự phân mức năng lượng, electron cuối cùng điến vào phân lớp d.
Câu 15:
03/07/2024Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron của R là [Ne].
Vậy số hiệu nguyên tử của R = số electron của R = 15.
Câu 16:
19/07/2024Một nguyên tố X có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của X có 35 proton. Đồng vị thứ nhất có 44 nơtron. Đồng vị thứ hai có nhiều hơn đồng vị thứ nhất là 2 nơtron. Nguyên tử khối trung bình của nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là:
Câu 17:
23/07/2024Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi x và y lần lượt là % số nguyên tử của hai đồng vị và .
Ta có:
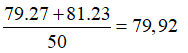
Câu 18:
10/07/2024Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
 Xem đáp án
Xem đáp án
Đáp án D
Ta có cấu hình electron nguyên tử của các nguyên tố là:
Cr: [Ar] → 1e lớp ngoài cùng.
Fe: [Ar] → 2e lớp ngoài cùng.
P: [Ne]3s23p3→ 5e lớp ngoài cùng.
Al: [Ne] → 3e lớp ngoài cùng.
Nguyên tố có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là P.
Câu 19:
03/07/2024Cấu hình electron nào sau đây là của kim loại
 Xem đáp án
Xem đáp án
Đáp án D
Nguyên tử có 1,2,3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại.
Ta có cấu hình e: → 2 e lớp ngoài cùng.
Câu 20:
18/07/2024Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố?
 Xem đáp án
Xem đáp án
Đáp án C
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
X và Z cùng số proton.
Câu 22:
08/07/2024Ion có 18 electron và 16 proton mang điện tích là
 Xem đáp án
Xem đáp án
Đáp án B
Ion có số electron > số proton → mang điện tích âm.
Số đơn vị điện tích âm là 18 – 16 = 2.
Vậy ion mang điện tích .
Câu 23:
03/07/2024Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
 Xem đáp án
Xem đáp án
Đáp án D
Câu 24:
19/07/2024Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án B
Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Câu 25:
25/10/2024Trên vỏ nguyên tử, các electron chuyển động xung quanh hạt nhân................
Hãy chọn cụm từ thích hợp đối với chỗ trống ở trên.
 Xem đáp án
Xem đáp án
Đáp án đúng là : B
- Các electron chuyển động xung quanh hạt nhân với vận tốc lớn và không theo quỹ đạo xác định.
→ B đúng.A,C,D sai.
* Sự chuyển động của electron trong nguyên tử
1. Sự chuyển động của electron trong nguyên tử
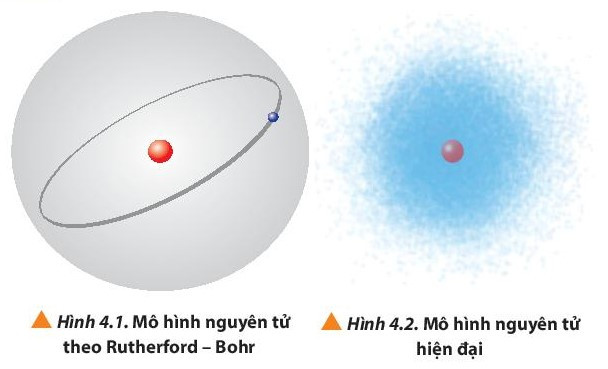
- Theo mô hình nguyên tử của Rutherford – Bohr (mô hình hành tinh nguyên tử), các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
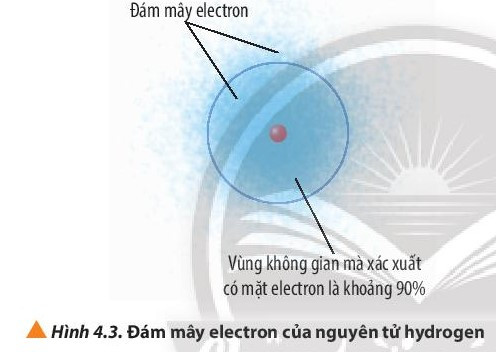
- Theo mô hình hiện đại, trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
2. Orbital nguyên tử
- Orbital nguyên tử (Atomic Orbital, viết tắt AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
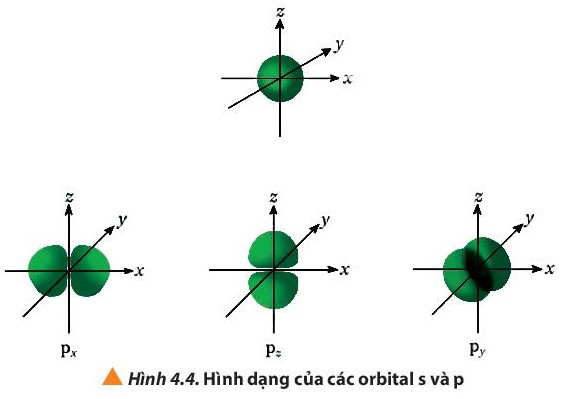
- Một số AO thường gặp: s, p, d, f
- Các AO có hình dạng khác nhau: AO s có dạng hình cầu, AO p có dạng hình số tám nổi, AO d và f có hình dạng phức tạp.
Xem thêm các bài viết lien quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Giải bài tập Hóa lớp 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Câu 26:
20/07/2024Trong tự nhiên Kali có ba đồng vị: ( = 93,258%); ( %); ( %). Biết nguyên tử khối trung bình của kali là 39,13. Giá trị của và lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 28:
03/07/2024Nguyên tử của nguyên tố nào sau đây có số hạt nơtron nhỏ nhất?
 Xem đáp án
Xem đáp án
Đáp án A
Số nơtron của F là 19 – 9 = 10.
Số nơtron của Ca, K và Sc đều là 20.
Câu 29:
15/07/2024Cho Mg có hai đồng vị ; . Cho Clo có hai đồng vị ; . Hỏi có tối đa bao nhiêu công thức dạng ?
 Xem đáp án
Xem đáp án
Đáp án A
Các công thức có thể có là: ; ; ; ; ;
Bài thi liên quan
-
Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 2)
-
30 câu hỏi
-
45 phút
-
-
Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 3)
-
30 câu hỏi
-
45 phút
-
-
Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 4)
-
30 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (307 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (329 lượt thi)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2600 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (760 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (620 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (735 lượt thi)
- Đề thi Hóa 10 Học kì 1 (557 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (449 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (505 lượt thi)
Các bài thi hot trong chương
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3252 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1277 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (868 lượt thi)
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (830 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (688 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (677 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (656 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (611 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (397 lượt thi)
