Đề kiểm tra giữa học kì 2 Hóa học 10 Kết nối tri thức có đáp án
Đề kiểm tra giữa học kì 2 Hóa học 10 Kết nối tri thức có đáp án - Đề 1
-
886 lượt thi
-
31 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án: D
Hợp chất NH4NO2 được tạo thành từ các ion: NH4+ và NO2-.
Gọi số oxi hoá của N trong NH4+ là x, ta có: x + (+1) × 4 = + 1 Þ x = -3.
Gọi số oxi hoá của N trong NO2- là y, ta có: y + (-2).2 = - 1 Þ y = +3.
Câu 5:
23/07/2024 Xem đáp án
Xem đáp án
Câu 6:
17/07/2024 Xem đáp án
Xem đáp án
Câu 9:
23/07/2024Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình hoá học của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 10:
13/07/2024Cho phương trình hóa học (với a, b, c, d là các hệ số):
aFeSO4 + bCl2 → cFe2(SO4)3 + dFeCl3
Tỉ lệ a : c là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 11:
18/07/2024Cho phản ứng 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Tỉ lệ số nguyên tử chloride bị khử và số nguyên tử chloride bị oxi hoá tương ứng là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 12:
14/07/2024 Xem đáp án
Xem đáp án
Đáp án: A
Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Theo PTHH có:
\[{n_{S{O_2}}} = {n_{Cu}} = \frac{{12,8}}{{64}} = 0,2\,(mol).\]
Vậy V = 0,2 × 24,79 = 4,958 (lít).
Câu 13:
21/07/2024Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu etylic có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH → CO2↑ + Cr2O3 + H2O
Tỉ lệ chất khử : chất oxi hoá ở phương trình hóa học trên là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 14:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án: C
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Tổng hệ số cân bằng của chất tham gia là: 2 + 2 = 4.
Câu 17:
22/07/2024Trong các phản ứng sau:
(1) Phản ứng đốt cháy than.
(2) Phản ứng nung vôi.
(3) Phản ứng nhiệt phân thuốc tím.
Phản ứng thu nhiệt là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 20:
22/07/2024Cho phương trình nhiệt hóa học của phản ứng
\[{\Delta _r}H_{298}^o = + 179,20kJ\]
Phản ứng trên là phản ứng
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án: A
Câu 23:
19/07/2024Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\[3Fe\left( s \right) + 4{H_2}O\left( l \right) \to F{e_3}{O_4}\left( s \right) + 4{H_2}\left( g \right)\] \[{\Delta _r}H_{298}^o = + 26,32kJ\]
Giá trị \[{\Delta _r}H_{298}^o\] của phản ứng: \[F{e_3}{O_4}\left( s \right) + 4{H_2}\left( g \right) \to 3Fe\left( s \right) + 4{H_2}O\left( l \right)\] là
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 24:
22/07/2024Cho phương trình hóa học của phản ứng:
\[{C_2}{H_4}\left( g \right) + {H_2}O\left( l \right) \to {C_2}{H_5}OH\left( l \right)\]
Biến thiên enthalpy của phản ứng là
Biết:
|
Chất |
C2H5OH |
C2H4 |
H2O |
|
\[{\Delta _f}H_{298}^0\] (kJ/ mol) |
-277,63 |
+52,47 |
-285,84 |
 Xem đáp án
Xem đáp án
Đáp án: B
Biến thiên enfhalpy của phản ứng tính theo nhiệt tạo thành chuẩn:
\[{\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0\left( {{C_2}{H_5}OH} \right){\rm{ }} - {\Delta _f}H_{298}^0\left( {{C_2}{H_4}} \right){\rm{ }} - {\Delta _f}H_{298}^0\left( {{H_2}O} \right)\]
= - 277,63 - (+52,47) - (-285,84) = -44,26 kJ.
Câu 26:
23/07/2024Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) → 2NH3(g).
Biết năng lượng liên kết (kJ/mol) của N ≡ N; N - H và H - H lần lượt là 946; 391 và 436.
Biến thiên enthalpy của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án: A
\[{\Delta _r}H_{298}^0\]= EN≡N + 3EH-H – 6EN-H = 946 + 3.436 – 6.391 = -92 kJ.
Câu 28:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án: C
Câu 29:
18/07/2024Cân bằng phản ứng sau bằng phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
a) SO2 + H2O + Cl2 → H2SO4 + HCl.
b) Fe(OH)2 + H2SO4 đặc Fe2(SO4)3 + SO2 + H2O.
 Xem đáp án
Xem đáp án
a) \[\mathop S\limits^{ + 4} {O_2} + {H_2}O + {\mathop {Cl}\limits^0 _2} \to {H_2}\mathop S\limits^{ + 6} {O_4} + H\mathop {Cl}\limits^{ - 1} \]
Chất oxi hoá: Cl2; chất khử: SO2
\[\left. \begin{array}{l}1 \times \\1 \times \end{array} \right|\begin{array}{*{20}{c}}{\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} \,\, + 2e}\\{\mathop {C{l_2}}\limits^0 \, + 2e \to 2\mathop {Cl}\limits^{ - 1} }\end{array}\]
Phương trình hóa học:
\(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl\).
b) \[\mathop {Fe}\limits^{ + 2} {(OH)_2} + {H_2}\mathop S\limits^{ + 6} {O_4} \to \mathop {F{e_2}}\limits^{ + 3} {(S{O_4})_3} + \mathop S\limits^{ + 4} {O_2} + {H_2}O\]
Chất khử: Fe(OH)2.
Chất oxi hóa: H2SO4.
Ta có các quá trình:
\[\begin{array}{l}2 \times \\1 \times \end{array}\] \[\left| \begin{array}{l}\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e\\\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \end{array} \right.\]
Phương trình hoá học:
2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O
Câu 30:
23/07/2024Cho phản ứng: N2 (g) + 3H2 (g) → 2NH3 (g) \[{\Delta _r}H_{298}^0 = - 92,22kJ.\]
a) Trong nhà máy sản xuất NH3, ban đầu phải đốt nóng N2 và H2 để phản ứng diễn ra. Nhiệt toả ra từ phản ứng này lại được dùng để đốt nóng N2 và H2 trong các phản ứng tiếp theo. Cách làm này có ý nghĩa gì về mặt kinh tế.
b) Tính enthalpy tạo thành chuẩn của NH3.
 Xem đáp án
Xem đáp án
a) Nhiệt toả ra từ phản ứng này lại được dùng để đốt nóng hỗn hợp N2 và H2 trong quá trình phản ứng tiếp theo. Cách làm này giúp tiết kiệm năng lượng do phản ứng xảy ra ở nhiệt độ cao.
b) Enthalpy tạo thành chuẩn của NH3:
\[{\Delta _f}H_{298}^0 = \frac{{ - 92,22}}{2} = - 46,11(kJ/mol).\]
Câu 31:
21/07/2024Cho phản ứng: C3H8(g) ⟶ CH4(g) + C2H4(g).
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn được cho ở bảng sau:
|
Liên kết |
C – H |
C – C |
C = C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
a) Tính biến thiên enthalpy của phản ứng trên.
b) Cho biết phản ứng là toả nhiệt hay thu nhiệt. Giải thích.
 Xem đáp án
Xem đáp án
a)
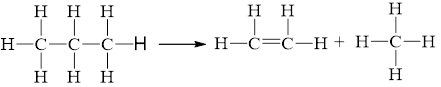
\({\Delta _r}H_{298}^o = 2.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}C} \right)}{\rm{ }} + {\rm{ }}8.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}H} \right)} - 1.{E_b}_{\left( {C{\rm{ }} = {\rm{ }}C} \right)}{\rm{ - }}8.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}H} \right)}\)
= 2.346 + 8.418 - 1.612 - 8.418 = +80 kJ.
b) Phản ứng là thu nhiệt do \[{\Delta _r}H_{298}^0 > 0.\]
Bài thi liên quan
-
Đề kiểm tra giữa học kì 2 Hóa học 10 Kết nối tri thức có đáp án - Đề 2
-
31 câu hỏi
-
60 phút
-
Có thể bạn quan tâm
Các bài thi hot trong chương
- Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Kết nối tri thức có đáp án (363 lượt thi)
- Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án (270 lượt thi)
