Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án
Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án- Đề 2
-
1223 lượt thi
-
33 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 5:
17/07/2024Cho các hợp chất sau: NH3; NH4Cl; NaNO3; HNO3; N2O5. Số hợp chất trong đó nitrogen có số oxi hoá -3 là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 6:
21/07/2024Cho các phản ứng hóa học sau:
(a)
(b)
(c)
(d)
Số phản ứng oxi hóa – khử là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 8:
15/07/2024Cho phản ứng: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Trong phản ứng trên, vai trò của SO2 là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 9:
16/07/2024Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 10:
22/07/2024Cho 4,2 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là (coi NO là sản phẩm khử duy nhất)
 Xem đáp án
Xem đáp án
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Theo phương trình hoá học:
Vậy VNO = 0,075.24,79 = 1,8593 (lít).
Câu 11:
12/07/2024Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + H2O. Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là
 Xem đáp án
Xem đáp án
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Câu 12:
13/07/2024Trong phản ứng: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O. Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
 Xem đáp án
Xem đáp án
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Þ Cứ 4 phân tử HNO3 tham gia phản ứng thì có 2 phân tử đóng vai trò là chất oxi hoá, 2 phân tử đóng vai trò là môi trường trong dung dịch.
Câu 13:
18/07/2024Trên thế giới, zinc (kẽm) được sản xuất chủ yếu từ quặng zinc blende có thành phần chính là ZnS. Ở giai đoạn đầu của quá trình sản xuất, quặng zinc blende được nung trong không khí để thực hiện phản ứng:
ZnS + O2 ZnO + SO2
Tổng hệ số cân bằng (là các số nguyên, tối giản) của chất tham gia trong phản ứng là
 Xem đáp án
Xem đáp án
Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
2ZnS + 3O2 2ZnO + 2SO2
Tổng hệ số của chất tham gia là: 2 + 3 = 5.
Câu 14:
16/07/2024Dẫn khí SO2 vào 10 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O H2SO4 + K2SO4 + MnSO4
Thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn là
 Xem đáp án
Xem đáp án
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
Theo phương trình hóa học ta có:
= 24,79.0,0005 = 0,012395 L = 12,395 (mL).
Câu 15:
20/07/2024Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 17:
21/07/2024Cho phản ứng sau:
C(s) + O2(g) → CO2(g)
Nhiệt tạo thành chuẩn của CO2(g) là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 18:
13/07/2024Cho các phản ứng sau:
(1) H2(g) + Cl2(g) ® 2HCl (g)
(2) CH4(g) + H2O(l) → CO(g) + 3H2(g)
Phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 19:
22/07/2024Cho các phát biểu sau:
(a). Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
(d). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
(e). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Số phát biểu không đúng là
 Xem đáp án
Xem đáp án
Phát biểu (b) và (d) không đúng.
Câu 20:
23/07/2024Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37 × 103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ.
B. 2,25 × 103 kJ.
C. 4,50 × 102 kJ.
D. 1,37 × 103 kJ.
ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
 Xem đáp án
Xem đáp án
Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
Câu 21:
18/07/2024Phương trình nhiệt học của phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2 ở điều kiện chuẩn, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 22:
20/07/2024Cho phản ứng sau:
SO2(g) + O2(g) ® SO3(l)
Biến thiên enthalpy chuẩn của phản ứng tính theo nhiệt tạo thành là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 23:
23/07/2024Xác định biến thiên enthalpy chuẩn của phản ứng:
C2H2(g) + 2H2(g) ® C2H6(g)
Biết năng lượng liên kết (ở điều kiện chuẩn): Eb (H–H) = 436 kJ/mol; Eb (C–H) = 418 kJ/mol; Eb (CºC) = 837 kJ/mol.
 Xem đáp án
Xem đáp án
Phương trình hóa học:
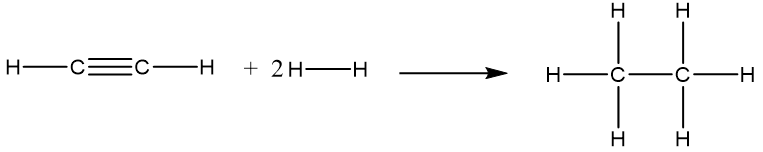
Vậy = Eb (CºC) + 2Eb (C–H) + 2Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 837 + 2×418 + 2×436 – 346 – 6×418 = –309 (kJ).
Câu 25:
10/07/2024Cho các phản ứng sau:
(1) Phản ứng tôi vôi: CaO + H2O → Ca(OH)2.
(2) Phản ứng trung hoà acid – base: HCl + NaOH → NaCl + H2O.
(3) Phản ứng nhiệt phân potassium chlorate: 2KClO3 2KCl + 3O2.
Phản ứng toả nhiệt là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 26:
19/07/2024Cho phản ứng sau:
CO(g) + O2(g) ® CO2(g)
Biến thiên enthalpy của phản ứng ở điều kiện chuẩn là
(Biết nhiệt tạo thành chuẩn của CO2(g) là –393,5 kJ/mol, của CO(g) là –110,5 kJ/mol).
 Xem đáp án
Xem đáp án
= –393,5 – (–110,5 + 0×) = –283 (kJ).
Câu 28:
16/07/2024Biến thiên enthalpy chuẩn của một phản ứng được mô tả ở sơ đồ dưới đây:
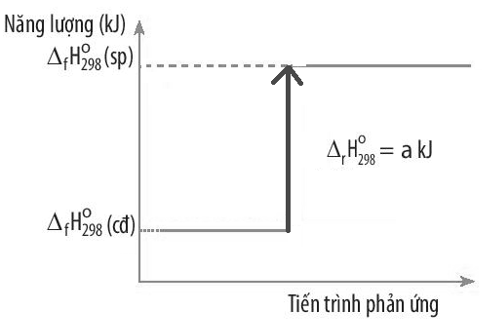
Kết luận nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 29:
11/07/2024Lập các phương trình hoá học sau theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
a) CaO + C CaC2 + CO.
 Xem đáp án
Xem đáp án
a)
Trong phản ứng C vừa đóng vai trò là chất oxi hoá, vừa đóng vai trò là chất khử.
Ta có các quá trình:
Quá trình oxi hóa:
Quá trình khử:
Phương trình hoá học:
CaO + 3C CaC2 + CO
Câu 30:
20/07/2024Lập các phương trình hoá học sau theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) .
 Xem đáp án
Xem đáp án
b)
- Chất khử: C12H22O11; chất oxi hóa: H2SO4.
Ta có các quá trình:
Quá trình oxi hoá:
Quá trình khử:
Phương trình hóa học:
Câu 31:
13/07/2024Cho phản ứng sau:
C(graphite) + O2(g) CO2(g)
a) Cho biết ý nghĩa của giá trị
 Xem đáp án
Xem đáp án
a) là lượng nhiệt toả ra khi tạo thành 1 mol CO2 (g) từ các đơn chất ở trạng thái bền nhất ở điều kiện chuẩn.
Câu 32:
15/07/2024b) Hợp chất CO2(g) bền hơn hay kém bền hơn về mặt năng lượng so với các đơn chất bền C(graphite) và O2(g).
 Xem đáp án
Xem đáp án
Câu 33:
20/07/2024Phosgene (COCl2) là một hợp chất hữu cơ, nó còn được gọi với tên là chất độc quang khí. Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính.
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C≡O) = 1075 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng tạo thành phosgene từ CO và Cl2.
 Xem đáp án
Xem đáp án
Áp dụng công thức:
= EC≡O + ECl – Cl – EC=O – 2EC – Cl
= 1075 + 243 – 745 – 2.339 = - 105 kJ.
Bài thi liên quan
-
Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án- Đề 1
-
32 câu hỏi
-
50 phút
-
Có thể bạn quan tâm
- Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án (1222 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án (407 lượt thi)
- Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Chân trời sáng tạo có đáp án (321 lượt thi)
