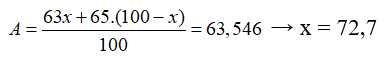Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1)
Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 1 - Đề 2)
-
2647 lượt thi
-
10 câu hỏi
-
15 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Trong nguyên tử, hạt không mang điện là
 Xem đáp án
Xem đáp án
Chọn D
Trong nguyên tử hạt không mang điện là nơtron.
Câu 2:
22/07/2024Ion có 18 electron và 16 proton mang điện tích là
 Xem đáp án
Xem đáp án
Chọn B
Hạt electron nhiều hơn hạt proton là 2 hạt. Vậy electron mang điện tích 2-.
Câu 3:
06/07/2024Tổng số hạt p, n, e trong nguyên tử là
 Xem đáp án
Xem đáp án
Chọn B
Số hạt p = e = 9, số n = A-p = 19 – 9 = 10.
Tổng số hạt p + n + e = 9 + 9 + 10 = 28.
Câu 4:
23/07/2024Cho cấu hình electron nguyên tử các nguyên tố sau
a)
b)
c)
d)
e)
Cấu hình của các nguyên tố phi kim là
 Xem đáp án
Xem đáp án
Chọn D
Nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
a) 1e lớp ngoài cùng
b) 7e lớp ngoài cùng
c) 3e lớp ngoài cùng
d) 2e lớp ngoài cùng
e) 6e lớp ngoài cùng
Vậy b và e là cấu hình electron nguyên tử của các nguyên tố phi kim.
Câu 5:
21/07/2024Nguyên tử khối trung bình của đồng là 63,546. Đồng tồn tại trong tự nhiên với 2 đồng vị là và . Thành phần trăm theo số nguyên tử của là
 Xem đáp án
Xem đáp án
Chọn D
Ta có, gọi % của đồng vị , thì % đồng vị
Vậy %là 27,3%.
Câu 6:
03/07/2024Nguyên tử nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không mang điện là 22 hạt. Số khối A của nguyên tử X là
 Xem đáp án
Xem đáp án
Chọn C
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt:
(p+e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n = 30
Số khối của X là A = z + n = p + n = 56.
Câu 7:
11/07/2024Số nguyên tố thuộc chu kỳ 3 là
 Xem đáp án
Xem đáp án
Chọn A
Các chu kì 3 là chu kì nhỏ, có 8 nguyên tố trong chu kì 3.
Câu 8:
03/07/2024Cho nguyên tố X có số hiệu nguyên tử là 17, vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học là
 Xem đáp án
Xem đáp án
Chọn A
Cấu hình electron nguyên tử X : [Ne]
X thuộc ô 17 do có z = 17, chu kỳ 3 do có 3 lớp electron, nhóm VIIA do 7 electron lớp ngoài cùng, nguyên tố p.
Câu 9:
08/12/2024Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì trong một chu kỳ các nguyên tố thuộc nhóm VIIA có tính phi kim mạnh nhất. Xét trong nhóm VIIA thì nguyên tố đứng đầu nhóm sẽ có tính phi kim mạnh nhất. Vậy Flo có tính phi kim mạnh nhất.
→ C đúng
- A sai vì tính chất phi kim yếu dần khi đi xuống nhóm trong bảng tuần hoàn. Theo quy luật, tính chất phi kim tăng dần từ trái sang phải và giảm dần khi đi xuống các nhóm, nên các phi kim như oxy hoặc flo mạnh hơn i-ốt.
- B sai vì tính chất kim loại tăng dần từ trên xuống dưới trong một nhóm và từ trái sang phải trong một chu kỳ. Mặc dù liti là kim loại nhẹ và có tính khử mạnh, nhưng kim loại như natri, kali hay cesi mạnh hơn liti về khả năng phản ứng và tính kim loại.
- D sai vì tính kim loại tăng dần khi đi xuống nhóm trong bảng tuần hoàn. Xesi là kim loại mạnh, có khả năng khử cao và dễ phản ứng, trong khi các kim loại như thủy ngân hay bạc yếu hơn về tính kim loại.
Flo (F) là phi kim mạnh nhất trong bảng tuần hoàn các nguyên tố, theo quy luật biến đổi tính chất đơn chất, vì:
-
Vị trí của flo trong bảng tuần hoàn:
- Flo nằm ở nhóm VIIA (nhóm halogen), chu kỳ 2.
- Đây là vị trí có năng lượng ion hóa cao và độ âm điện lớn nhất.
-
Độ âm điện cao nhất:
- Flo có độ âm điện là 3,98, cao nhất trong tất cả các nguyên tố, thể hiện khả năng mạnh mẽ trong việc hút electron từ các nguyên tử khác để tạo liên kết.
-
Kích thước nguyên tử nhỏ:
- Kích thước nguyên tử của flo nhỏ, làm cho lực hút giữa hạt nhân và electron liên kết trở nên rất mạnh. Điều này tăng cường tính chất phi kim của flo.
-
Khả năng oxy hóa mạnh:
- Flo có khả năng nhận electron rất mạnh, nên được xem là chất oxy hóa mạnh nhất.
- Nó phản ứng với hầu hết các nguyên tố, kể cả các khí hiếm trong điều kiện đặc biệt.
-
So sánh với các phi kim khác:
- Tính phi kim giảm dần khi đi từ flo xuống các nguyên tố cùng nhóm (Cl, Br, I) và khi đi từ phải sang trái trong bảng tuần hoàn.
Như vậy, flo là phi kim mạnh nhất do đặc điểm cấu tạo nguyên tử và tính chất hóa học đặc trưng.
Câu 10:
19/07/2024Nguyên tố R thuộc chu kì 3, nhóm VIIA trong bảng tuần hoàn. Công thức oxit cao nhất của R là
 Xem đáp án
Xem đáp án
Chọn B
R thuộc nhóm VIIA nên có 7e lớp ngoài cùng. Trong công thức oxit cao nhất của R, R có hóa trị VII.
Vậy công thức oxit cao nhất của R là
Bài thi liên quan
-
Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 1 - Đề 1)
-
10 câu hỏi
-
15 phút
-
-
Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 1 - Đề 3)
-
10 câu hỏi
-
15 phút
-
-
Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 1 - Đề 4)
-
10 câu hỏi
-
15 phút
-
Có thể bạn quan tâm
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (316 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (344 lượt thi)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2646 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (791 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (643 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (756 lượt thi)
- Đề thi Hóa 10 Học kì 1 (582 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (487 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (536 lượt thi)
Các bài thi hot trong chương
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3364 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1303 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (909 lượt thi)
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (866 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (720 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (705 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (689 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (623 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (410 lượt thi)