Câu hỏi:
31/10/2024 9,128
Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
A. HF có phân tử khối lớn nhất.
A. HF có phân tử khối lớn nhất.
B. HF có liên kết hydrogen.
B. HF có liên kết hydrogen.
C. HF có tương tác van der Waals lớn nhất.
C. HF có tương tác van der Waals lớn nhất.
D. HF là hợp chất phân cực nhất.
D. HF là hợp chất phân cực nhất.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: B
- HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI vì HF có liên kết hydrogen.
Liên kết hydrogen mạnh mẽ hơn rất nhiều so với tương tác van der Waals
Giữa các phân tử hydrogen fluoride (HF) có liên kết hydrogen:
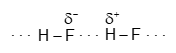
Còn giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
Điều này giải thích vì sao nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
→ B đúng.A,C,D sai.
* Liên kết hydrogen
1. Khái niệm
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
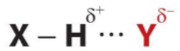
Trong đó, X, Y là các nguyên tử N, O, F
- Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa Hδ+và Yδ−thể hiện bản chất của liên kết hydrogen.
Ví dụ 1: Liên kết hydrogen được tạo ra giữa hai phân tử nước được thể hiện qua hình 12.1.
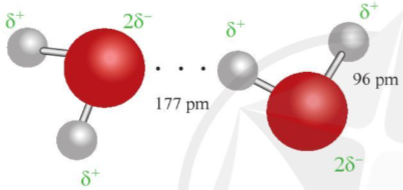
Ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hóa trị O – H (96pm), đã xuất hiện liên kết hydrogen.
Lưu ý: Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
® Đây là nguyên nhân dẫn tới các tính chất vật lí khác biệt của nước so với những chất lỏng khác. Do đặc điểm tập hợp đặc biệt này, khi làm lạnh, nước có thể hình thành bông tuyết với nhiều hình dạng khác nhau.
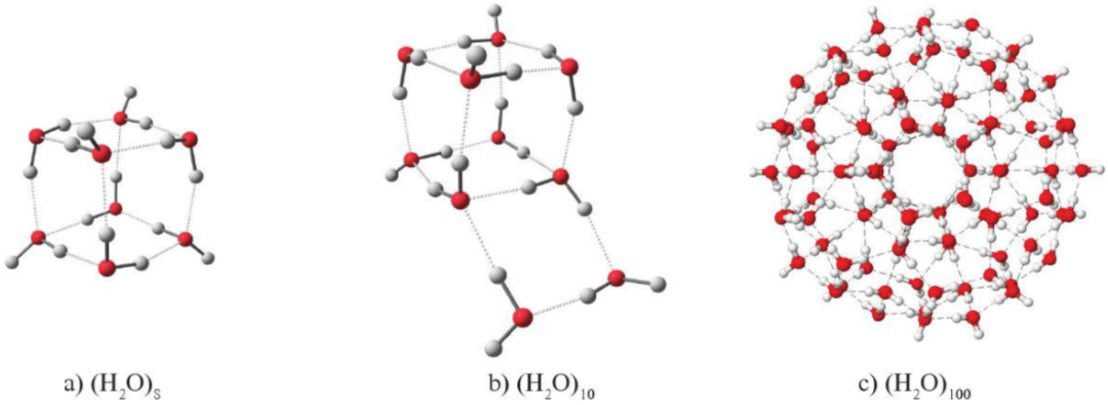
Hình 12.2. Một số cụm phân tử nước
b) Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Chú ý: Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ các liên kết giữa các phân tử và cung cấp động năng để các phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Đáp án đúng là: B
- HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI vì HF có liên kết hydrogen.
Liên kết hydrogen mạnh mẽ hơn rất nhiều so với tương tác van der Waals
Giữa các phân tử hydrogen fluoride (HF) có liên kết hydrogen:
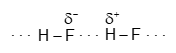
Còn giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
Điều này giải thích vì sao nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
→ B đúng.A,C,D sai.
* Liên kết hydrogen
1. Khái niệm
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
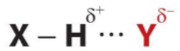
Trong đó, X, Y là các nguyên tử N, O, F
- Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa Hδ+và Yδ−thể hiện bản chất của liên kết hydrogen.
Ví dụ 1: Liên kết hydrogen được tạo ra giữa hai phân tử nước được thể hiện qua hình 12.1.

Ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hóa trị O – H (96pm), đã xuất hiện liên kết hydrogen.
Lưu ý: Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
® Đây là nguyên nhân dẫn tới các tính chất vật lí khác biệt của nước so với những chất lỏng khác. Do đặc điểm tập hợp đặc biệt này, khi làm lạnh, nước có thể hình thành bông tuyết với nhiều hình dạng khác nhau.

Hình 12.2. Một số cụm phân tử nước
b) Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Chú ý: Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ các liên kết giữa các phân tử và cung cấp động năng để các phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Hợp chất nào sau đây không tạo được liên kết hydrogen liên phân tử?
Hợp chất nào sau đây không tạo được liên kết hydrogen liên phân tử?
Câu 2:
Trong dung dịch ethanol (C2H5OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
Trong dung dịch ethanol (C2H5OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
Câu 4:
Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên
Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên
Câu 5:
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
Câu 7:
Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
Câu 8:
Nguyên tử nào sau đây khi hình thành ion có khuynh hướng nhường 1 electron?
Nguyên tử nào sau đây khi hình thành ion có khuynh hướng nhường 1 electron?
Câu 10:
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
Câu 14:
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
Câu 15:
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:


