Câu hỏi:
05/11/2024 436
Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: C
- Tương tác van der Waals được hình thành do tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
- Liên kết van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hoặc phân tử.
→ A,B sai.
- Lực Van der Waals là lực tĩnh điện, thường xuất hiện giữa các phân tử chất khí, khí hóa lỏng hoặc hóa rắn, và trong hầu hết các chất lỏng và chất rắn hữu cơ.
→ D sai.
* Tương tác van der Waals
1. Khái niệm tương tác van der Waals
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
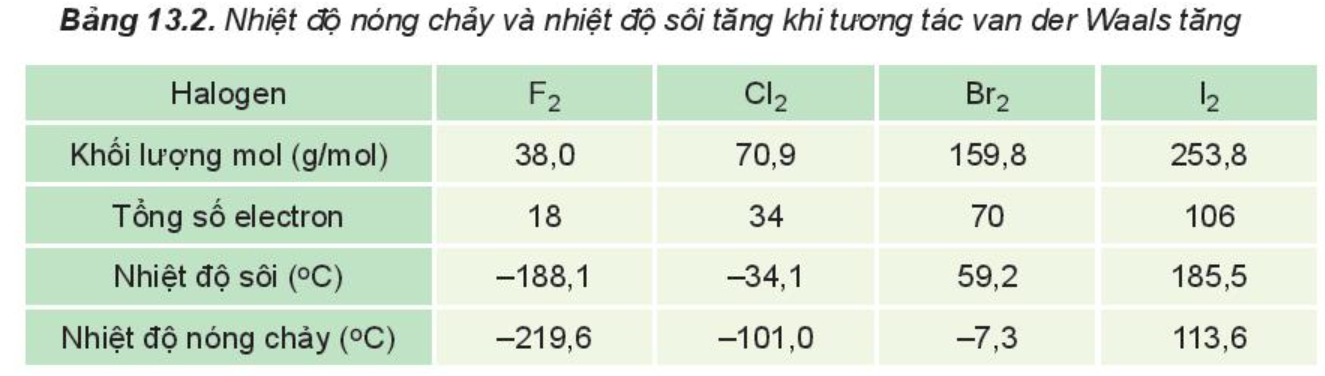
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals
Giải bài tập Hóa lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 5:
Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
Câu 6:
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết trong phân tử F2. Biết F (Z = 9).
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết trong phân tử F2. Biết F (Z = 9).
Câu 8:
Biểu diễn sự tạo thành liên kết ion trong phân tử MgO. Biết Mg (Z = 12) và O (Z = 8).
Biểu diễn sự tạo thành liên kết ion trong phân tử MgO. Biết Mg (Z = 12) và O (Z = 8).
Câu 9:
Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
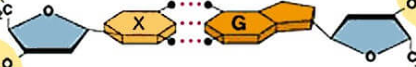
Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?

Câu 10:
Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
Câu 12:
Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
Câu 13:
Dựa vào hiệu độ âm điện giữa 2 nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất?
Câu 14:
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
Công thức electron nào sau đây không đủ electron theo quy tắc octet?


