Câu hỏi:
23/07/2024 2,896
Trình bày phương pháp hoá học phân biệt ba dung dịch: NH4NO3, KNO3, NH4Cl.
Trình bày phương pháp hoá học phân biệt ba dung dịch: NH4NO3, KNO3, NH4Cl.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Sử dụng lần lượt hai dung dịch thuốc thử là NaOH và AgNO3
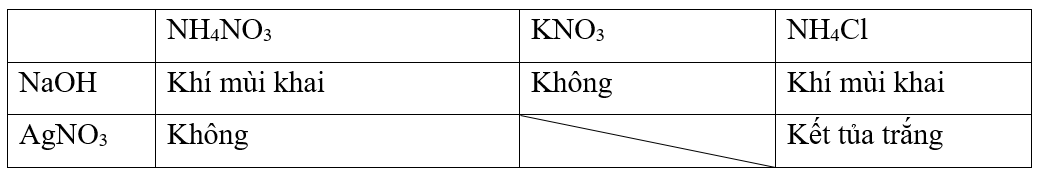
Các phương trình hóa học:
Sử dụng lần lượt hai dung dịch thuốc thử là NaOH và AgNO3

Các phương trình hóa học:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Xét cân bằng hoá học:
Hằng số cân bằng (Kc) của phản ứng được biểu diễn bằng biểu thức nào sau đây?
A.
B.
C.
D.
Xét cân bằng hoá học:
Hằng số cân bằng (Kc) của phản ứng được biểu diễn bằng biểu thức nào sau đây?
A.
B.
C.
D.
Câu 2:
Tại một nhà máy phân bón, ammophos được sản xuất từ ammonia và phosphoric acid, thu được NH4H2PO4 và (NH4)2HPO4 tỉ lệ mol là 1:1.
a) Viết các phương trình hoá học.
b) Tính thể tích khí ammonia (đkkc) cần dùng để tác dụng vừa đủ với dung dịch chứa 5,88 tấn phosphoric acid. Tính khối lượng ammophos thu được.
Tại một nhà máy phân bón, ammophos được sản xuất từ ammonia và phosphoric acid, thu được NH4H2PO4 và (NH4)2HPO4 tỉ lệ mol là 1:1.
a) Viết các phương trình hoá học.
b) Tính thể tích khí ammonia (đkkc) cần dùng để tác dụng vừa đủ với dung dịch chứa 5,88 tấn phosphoric acid. Tính khối lượng ammophos thu được.
Câu 3:
Hỗn hợp gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450oC có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Hiệu suất của phản ứng tổng hợp NH3 là
A. 20%.
B. 25%.
C. 30%..
D. 10%.
Hỗn hợp gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450oC có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Hiệu suất của phản ứng tổng hợp NH3 là
A. 20%.
B. 25%.
C. 30%..
D. 10%.
Câu 4:
Xét cân bằng trong dung dịch gồm NH4Cl 0,1 M và NH3 0,05 M ở 25oC:
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Xét cân bằng trong dung dịch gồm NH4Cl 0,1 M và NH3 0,05 M ở 25oC:
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Câu 5:
Xét cân bằng hoá học:
Hiệu suất phản ứng khi hệ đạt cân bằng ở áp suất 200 bar và 300 bar lần lượt bằng x% và y%. Mối quan hệ giữa x và y là
A. 5x = 4y.
B. x = y.
C. x > y,
D. x < y.
Xét cân bằng hoá học:
Hiệu suất phản ứng khi hệ đạt cân bằng ở áp suất 200 bar và 300 bar lần lượt bằng x% và y%. Mối quan hệ giữa x và y là
A. 5x = 4y.
B. x = y.
C. x > y,
D. x < y.
Câu 6:
Hỗn hợp khí X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng trong bình kín có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là
A. 25%.
B. 23%.
C. 16%.
D. 20%.
Hỗn hợp khí X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng trong bình kín có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là
A. 25%.
B. 23%.
C. 16%.
D. 20%.
Câu 7:
Xét cân bằng hoá học:
Hiệu suất phản ứng khi hệ đạt cân bằng ở nhiệt độ 400oC và 500oC lần lượt bằng x% và y%. Mối quan hệ giữa x và y là
A. x < y.
B. x = y.
C. x > y.
D. 5x = 4y.
Câu 8:
Viết phương trình hoá học xảy ra khi cho dung dịch (NH4)2CO3 lần lượt tác dụng với lượng dư các dung dịch: HCl, Ba(OH)2.
Viết phương trình hoá học xảy ra khi cho dung dịch (NH4)2CO3 lần lượt tác dụng với lượng dư các dung dịch: HCl, Ba(OH)2.
Câu 9:
Xét cân bằng hoá học:
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sau đây?
A. NH4Cl
B. NaOH.
C. HCl.
D. NaCl.
Xét cân bằng hoá học:
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sau đây?
A. NH4Cl
B. NaOH.
C. HCl.
D. NaCl.
Câu 10:
Phát biểu nào sau đây không đúng?
A. Ammonia là base Brønsted khi tác dụng với nước.
B. Ammonia được sử dụng là chất làm lạnh.
C. Muối ammonium là tinh thể ion, dễ tan trong nước.
D. Các muối ammonium đều rất bền với nhiệt.
Phát biểu nào sau đây không đúng?
A. Ammonia là base Brønsted khi tác dụng với nước.
B. Ammonia được sử dụng là chất làm lạnh.
C. Muối ammonium là tinh thể ion, dễ tan trong nước.
D. Các muối ammonium đều rất bền với nhiệt.
Câu 11:
Khí nào sau đây dễ tan trong nước do tạo được liên kết hydrogen với nước?
A. Nitrogen.
B. Hydrogen.
C. Ammonia.
D. Oxygen.
Khí nào sau đây dễ tan trong nước do tạo được liên kết hydrogen với nước?
A. Nitrogen.
B. Hydrogen.
C. Ammonia.
D. Oxygen.
Câu 12:
Các chất khí được thu vào bình theo đúng nguyên tắc bằng cách đầy không khí (X, Y, Z) và đẩy nước (T) như sau:
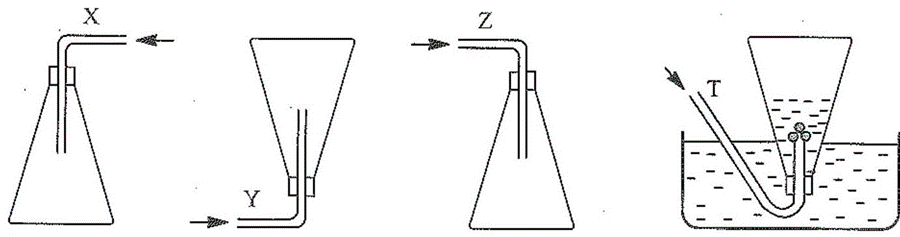 Nhận xét nào sau đây không đúng?
Nhận xét nào sau đây không đúng?
A. X là chlorine.
B. Y là hydrogen.
C. Z là nitrogen dioxide.
D. T là ammonia.
Các chất khí được thu vào bình theo đúng nguyên tắc bằng cách đầy không khí (X, Y, Z) và đẩy nước (T) như sau:
 Nhận xét nào sau đây không đúng?
Nhận xét nào sau đây không đúng?A. X là chlorine.
B. Y là hydrogen.
C. Z là nitrogen dioxide.
D. T là ammonia.
Câu 13:
Tiến hành thí nghiệm trộn từng dung dịch sau: (a) NH3 và AlCl3; (b) (NH4)2SO4 và Ba(OH)2; (c) NH4Cl và AgNO3; (d) NH3 và HCl. Sau khi phản ứng kết thúc, số thí nghiệm thu được kết tủa là
A. 1.
B. 3.
C. 2.
D. 4.
Tiến hành thí nghiệm trộn từng dung dịch sau: (a) NH3 và AlCl3; (b) (NH4)2SO4 và Ba(OH)2; (c) NH4Cl và AgNO3; (d) NH3 và HCl. Sau khi phản ứng kết thúc, số thí nghiệm thu được kết tủa là
A. 1.
B. 3.
C. 2.
D. 4.
Câu 14:
Phân biệt được đung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch
A. KCl.
B. KNO3.
C. KOH.
D. K2SO4.
Phân biệt được đung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch
A. KCl.
B. KNO3.
C. KOH.
D. K2SO4.
Câu 15:
Sự phụ thuộc của độ tan khí ammonia trong nước vào nhiệt độ được mô tả ở hình bên.
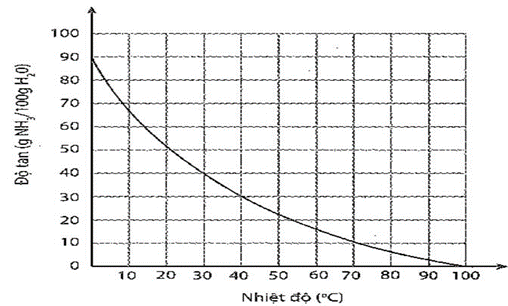
Sự phụ thuộc của độ tan khi ammonia vào nhiệt độ
Dựa vào đồ thị ở hình bên, hãy xác định:
a) Độ tan của ammonia ở 30oC. Nhận xét về tính tan của ammonia ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch ammonia bão hoà ở 30oC.
c) Độ tan của ammonia ở 60oC. So sánh với độ tan của ammonia ở 30oC. Giải thích.
Sự phụ thuộc của độ tan khí ammonia trong nước vào nhiệt độ được mô tả ở hình bên.

Sự phụ thuộc của độ tan khi ammonia vào nhiệt độ
Dựa vào đồ thị ở hình bên, hãy xác định:
a) Độ tan của ammonia ở 30oC. Nhận xét về tính tan của ammonia ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch ammonia bão hoà ở 30oC.
c) Độ tan của ammonia ở 60oC. So sánh với độ tan của ammonia ở 30oC. Giải thích.


