Giải SBT Hóa học 11 CD Bài 5: Một số hợp chất quan trọng của nitrogen
Giải SBT Hóa học 11 CD Bài 5: Một số hợp chất quan trọng của nitrogen
-
90 lượt thi
-
18 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
08/07/2024Nối tính chất của ammonia ở cột A với các biểu hiện tính chất ở cột B cho phù hợp.
|
Cột A |
Cột B |
|
a) Tính chất vật lí |
1. Làm quỳ tím hóa xanh |
|
b) Tính base |
2. Tan trong nước tạo môi trường có pH > 7 |
|
c) Tính khử |
3. Tan vô hạn trong nước |
|
|
4. Phản ứng với acid tạo muối ammonium |
|
|
5. Phản ứng với oxygen |
|
|
6. Phản ứng với một số oxide kim loại tạo ra kim loại và khí nitrogen |
 Xem đáp án
Xem đáp án
Đáp án đúng là: a – 3; b – 1, 2, 4; c – 5,6.
Câu 2:
23/07/2024Phát biểu nào sau đây là không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Ammonia được sử dụng cho sản xuất phân đạm chứa gốc ammonium, urea để dung cấp nguyên tố nitrogen cho đất và cây trồng.
Câu 3:
23/07/2024N2(g) + H2(g) 2NH3(g) = −92kJ (1)
Những phát biểu liên quan tới quá trình Haber nào sau đây là đúng?
(a) Là quá trình thuận nghịch nên tại thời điểm cân bằng, hỗn hợp trong buồng phản ứng gồm ammonia, nitrogen và hydrogen.
(b) Do ammonia dễ hoá lỏng hơn nên khi làm lạnh hỗn hợp sẽ tách được ammonia lỏng ra khỏi hỗn hợp khí.
(c) Nếu không sử dụng chất xúc tác thì không thể tạo thành ammonia.
(d) Nếu giảm áp suất của hệ thì phản ứng sẽ chuyển dịch theo chiều thuận.
(e) Phản ứng thuận là phản ứng toả nhiệt. Vì vậy, để phản ứng chuyển dịch theo chiều thuận, cần phải giảm nhiệt độ. Tuy nhiên, nếu giảm nhiệt độ xuống thấp thì tốc độ phản ứng lại nhỏ.
(g) Từ giá trị biến thiên enthalpy chuẩn của phản ứng trên và năng lượng liên kết H−H, N−H lần lượt là 436 kJ mol−1 và 389 kJ mol−1 sẽ xác định được năng lượng liên kết trong phân tử N2 ở cùng điều kiện là 934 kJ mol−1.
 Xem đáp án
Xem đáp án
Đáp án đúng là: (a), (b), (e), (g).
Năng lượng liên kết trong phân tử N2 được tính như sau:
EN ≡ N = − 92 + 6. 389 – 3. 436 = 934 kJ mol−1.
Câu 4:
22/07/2024Kết quả nghiên cứu sự phụ thuộc của hiệu suất tổng hợp ammonia (theo phương trình hoá học (1), Câu 5.3) vào áp suất và nhiệt độ của phản ứng được thể hiện ở giản đồ trong Hình 5 dưới đây:
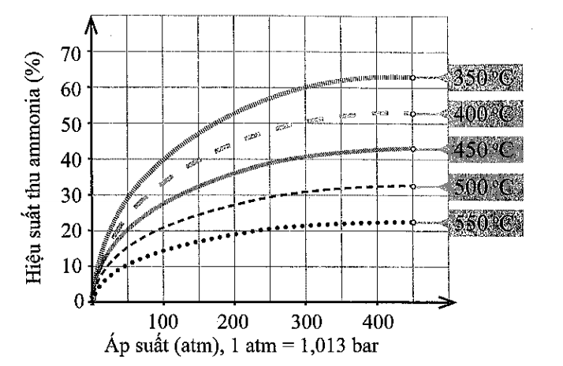
Hình 5. Sự phụ thuộc của hiệu suất tổng hợp ammonia vào áp suất và nhiệt độ phản ứng (Nguồn: Cowbridge Chemistry Department: Making ammonia − The Haber process http://ccschemistry.blogspot.com/2016/, truy cập ngày 22-3-2023.)
Hiệu suất thu ammonia có thể được tính theo công thức:

Khi phản ứng ưu tiên diễn ra theo chiều thuận thì lượng ammonia thu được trong thực tế càng nhiều.
a) Trong khoảng từ 350oC đến 550oC, hiệu suất thu ammonia biến đổi theo xu hướng nào?
 Xem đáp án
Xem đáp án
a) Trong khoảng từ 350oC đến 550oC, hiệu suất thu ammonia biến đổi theo xu hướng giảm.
Câu 5:
06/07/2024b) Vì sao nhiệt độ phản ứng càng cao thì hiệu suất thu ammonia càng thấp?
 Xem đáp án
Xem đáp án
b) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức phản ứng nghịch. Điều đó làm giảm hiệu suất thu ammonia.
Câu 6:
20/07/2024c) Ở một nhiệt độ, vì sao áp suất tăng cao thì hiệu suất thu ammonia tăng?
 Xem đáp án
Xem đáp án
c) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi áp suất tăng thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức chiều giảm số mol khí, chiều thuận. Điều đó làm tăng hiệu suất thu ammonia.
Câu 7:
06/07/2024d) Từ giản đồ Hình 5, hãy cho biết nên chọn nhiệt độ phản ứng là bao nhiêu để hiệu suất phản ứng đạt khoảng 44% ở 200 atm.
 Xem đáp án
Xem đáp án
d) Từ giản đồ thấy nên chọn nhiệt độ phản ứng khoảng 400oC.
Câu 8:
19/07/2024Viết các phương trình hoá học của phản ứng sản xuất NH4Cl, NH4NO3, (NH4)2SO4 và (NH2)2CO từ ammonia để làm phân bón vô cơ. Cho biết đó có phải là các phản ứng oxi hoá − khử không. Những phản ứng trên có tạo thành chất gây ô nhiễm môi trường không?
 Xem đáp án
Xem đáp án
- Quá trình sản xuất NH4Cl, NH4NO3, (NH4)2SO4 theo phản ứng trực tiếp giữa ammonia và acid tương ứng; đó không phải là các phản ứng oxi hóa – khử.
- Quá trình sản xuất urea theo phản ứng:
2NH3 + CO2 to, p⇌ (NH2)2CO + H2O
Đây không phải là phản ứng oxi hoá - khử.
- Các phản ứng trên không tạo khí độc. Tuy nhiên khi sử dụng dư thừa, phân bón chứa các chất này sẽ gây hiện tượng phú dưỡng cho nước và đất.
Câu 9:
22/07/2024Giá trị biến thiên enthalpy chuẩn quá trình hoà tan trong nước của urea và ammonium sulfate lần lượt là 15,4 kJ mol−1 và 6,60 kJ mol−1.
a) Có hai ống nghiệm cùng dung tích. Mỗi ống nghiệm được đặt vừa khít vào lỗ trống đã được khoét sẵn trên miếng xốp cách nhiệt dày. Cho vào mỗi ống nghiệm 10 mL nước ở cùng nhiệt độ. Cắm nhiệt kế thuỷ ngân cùng loại vào mỗi ống nghiệm. Chờ dung dịch ổn định đến nhiệt độ phòng; sau đó, cho 2 gam phân bón urea vào ống nghiệm thứ nhất, 2 gam phân bón ammonium sulfate vào ống nghiệm thứ hai. Nhanh chóng dùng đũa thuỷ tinh khuấy nhẹ để phân bón tan hết. Mức thuỷ ngân trong nhiệt kế ở ống nghiệm nào sẽ thấp hơn? Giải thích.
 Xem đáp án
Xem đáp án
a) Mức thuỷ ngân trong ống nghiệm chứa urea sẽ thấp hơn do quá trình hoà tan urea thu nhiều nhiệt hơn.
Câu 10:
21/07/2024b) Có thể phân biệt nhanh phân bón urea và phân bón ammonium sulfate bằng một lượng nước phù hợp được không? Giải thích.
 Xem đáp án
Xem đáp án
b) Có thể phân biệt được nhanh phân bón urea và phân bón ammonium sulfate bằng một lượng nước phù hợp dựa vào nhiệt hoà tan.
Câu 11:
23/07/2024Trong các công thức dưới đây, có bao nhiêu công thức không thỏa mãn quy tắc octet?
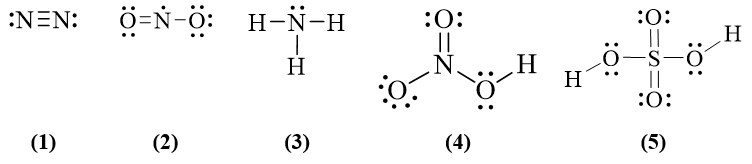
A. 1. B. 2. C. 3. D. 4.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức (2) và (5) không thỏa mãn quy tắc octet.
Câu 12:
17/07/2024a)Viết cấu hình electron của nguyên tử nitrogen (7N) theo ô orbital. Nguyên tử N có bao nhiêu electron hoá trị ghép đôi, bao nhiêu electron hoá trị độc thân?
 Xem đáp án
Xem đáp án
a) Cấu hình electron của nitrogen theo ô orbital:
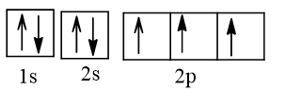
Có 1 cặp electron hoá trị ghép đôi, 3 electron hoá trị độc thân.
Câu 13:
22/07/2024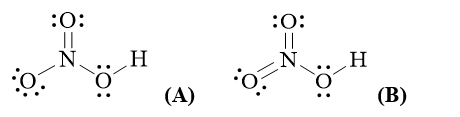
b1) Công thức (A) hay (B) phù hợp với đặc điểm các electron hoá trị của nguyên tử nitrogen? Theo công thức đó, hoá trị và số oxi hoá của N là bao nhiêu?
b2*) Kết quả nghiên cứu cho biết giá trị độ dài các liên kết giữa nguyên tử N và O (liên kết NO) trong phân tử HNO3 là 1,406 Å; 1,211 Å và 1,199 Å. Công thức (A) hay (B) có thể thoả mãn các số liệu đã cho? Giải thích.
 Xem đáp án
Xem đáp án
b)
b1)Công thức (A) phù hợp hơn vì nguyên tử N chỉ có 4 orbital hoá trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hoá trị. Theo công thức (A), N có hoá trị là IV và số oxi hoá là +5.
b2*) Công thức (A) phù hợp với dữ liệu do có ba loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (1 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hoá trị và 1 liên kết đơn theo kiểu cho - nhận).
Câu 14:
19/07/2024Cho hai quá trình sau:
NH4NO3(s) ⟶ N2O(g) + 2H2O(g) = −36 kJ
NH4Cl(s) ⟶ NH3(g) + HCl(g) = 176 kJ
Ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Trong quá trình lưu trữ, dưới ảnh hưởng của nhiệt, phân bón nào có nguy cơ cháy, nổ cao hơn? Giải thích.
 Xem đáp án
Xem đáp án
Phân ammonium nitrate có nguy cơ cháy, nổ cao hơn, do phản ứng phân huỷ phát nhiều nhiệt. Ví dụ, vụ nổ ở Beirut, Lebanon (Li-băng) năm 2020 làm hàng trăm người chết, hàng trăm nghìn người mất nhà cửa; nguyên nhân được cho là liên quan đến 2 750 tấn ammonium nitrate được cất giữ ở cảng suốt 6 năm một cách không an toàn. Vụ nổ có sức công phá tương đương 1 200 tấn thuốc nổ TNT.
Câu 15:
23/07/2024Trong quy trình sản xuất tơ, mỗi năm có hàng triệu tấn cyclohexanone (C6H10O) được cho phản ứng với HNO3 để tạo adipic acid (C6H10O4) theo phản ứng:
C6H10O + HNO3 ⟶ C6H10O4 + N2O + H2O
a) Cân bằng phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron.
 Xem đáp án
Xem đáp án
a) Cách cân bằng:
−43C6H10O + H+5NO3→−13C6H10O4+ +1N2O + H2O
Ta có các quá trình:
4×3×|6−43C→6−13C+6e2+5N+8e→2+1N
Vậy: 4C6H10O + 6HNO3 ⟶ 4C6H10O4 + 3N2O + 3H2O
Câu 16:
09/07/2024b) Cho biết vai trò của HNO3 trong phản ứng trên. Giải thích.
 Xem đáp án
Xem đáp án
b) Do số oxi hoá của N đã giảm từ +5 (trong HNO3) xuống +1 (trong N2O) nên HNO3 đóng vai trò chất oxi hoá.
Câu 17:
23/07/2024Vàng tan trong hỗn hợp gồm dung dịch nitric acid đặc và dung dịch hydrochloric acid đặc (tỉ lệ 1 : 3 về thể tích) tạo ra hợp chất tan của Au3+ theo phản ứng sau:
Au + HNO3 + HCl ⟶ HAuCl4 + H2O + NO
a) Cân bằng phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron.
 Xem đáp án
Xem đáp án
a) Cách cân bằng:
0Au + H+5NO3+ 4HCl→H+3AuCl4+ 2H2O + +2NO
Ta có các quá trình:
1×1×|0Au→+3Au+3e+5N+3e→+2N
Vậy: Au + HNO3 + 4HCl ⟶ HAuCl4 + 2H2O + NO
Câu 18:
10/07/2024b) Cho biết acid nào đóng vai trò chất oxi hoá trong phản ứng trên. Giải thích.
 Xem đáp án
Xem đáp án
b) Do số oxi hoá của N đã giảm từ +5 (trong HNO3) xuống +2 (trong NO) nên HNO3 đóng vai trò chất oxi hoá.
