Giải SBT Hóa học 10 Bài 11. Liên kết ion có đáp án
Giải SBT Hóa học 10 Bài 11. Liên kết ion có đáp án
-
60 lượt thi
-
16 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
21/07/2024Liên kết ion được tạo thành giữa hai nguyên tử bằng
 Xem đáp án
Xem đáp án
Liên kết ion được tạo thành giữa hai nguyên tử bằng lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Khi kim loại calcium kết hợp với phi kim oxygen, tạo thành các ion Ca2+ và O2–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
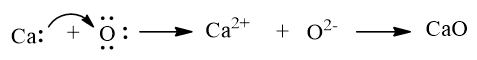
Câu 2:
19/07/2024Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
 Xem đáp án
Xem đáp án
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa cation và anion.
Cation: ion mang điện tích dương (Ví dụ: Ca2+)
Anion: ion mang điện tích âm (ví dụ: O2-)
Câu 3:
15/07/2024Biểu diễn sự tạo thành ion nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai vì Na có 1 electron lớp ngoài cùng. Khi tham gia hình thành liên kết hóa học Na có xu hướng nhường đi 1 electron.
Sửa lại: Na → Na+ + 1e
B. Sai vì Cl có 7 electron lớp ngoài cùng. Có xu hướng nhận thêm 1 electron khi hình thành liên kết hóa học.
Sửa lại: Cl2 + 2e → 2Cl-
C. Sai vì mỗi nguyên tử O nhận 2 electron để tạo thành ion O2- ⇒ phân tử O2 nhận 4 electron để tạo thành 2 ion O2-
Sửa lại: O2 + 4e → 2O2-
D. Đúng vì aluminium có 3 electron lớp ngoài cùng, có xu hướng nhường đi 3 electron khi hình thành liên kết hóa học.
Câu 4:
17/07/2024 Xem đáp án
Xem đáp án
N (Z = 7); H (Z = 1)
Tổng số proton trong ion NH4+ là 7 + 4.1 = 11
Tổng số electron trong ion NH4+ là: Số proton – điện tích ion = 11 – 1 = 10
Câu 5:
13/07/2024Cặp nguyên tử nào sau đây không tạo hợp chất dạng X2+Y2- hoặc X2+Y2-?
 Xem đáp án
Xem đáp án
- Trong hợp chất X2+Y2-
+ Nguyên tử X nhường 1 electron tạo thành X+ ⇒ Na, K thỏa mãn
+ Nguyên tử Y nhận 2 electron tạo thành Y2- ⇒ O, S thỏa mãn
- Trong hợp chất X2+Y2-
+ Nguyên tử X nhường 2 electron tạo thành X2+ ⇒ Ca thỏa mãn
+ Nguyên tử Y nhận 1 electron tạo thành Y- ⇒ Cl thỏa mãn, O không thỏa mãn.
Câu 6:
15/07/2024 Xem đáp án
Xem đáp án
Tính chất chung của hợp chất ion là: Thường là chất rắn, có nhiệt độ nóng chảy và nhiệt độ sôi cao, có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.
Câu 7:
13/07/2024Cho các phân tử sau: HCl, NaCl, CaCl2, AlCl3
Phân tử có liên kết mang nhiều tính ion nhất là
 Xem đáp án
Xem đáp án
Phân tử có liên kết mang nhiều tính ion nhất ⇒ lớn nhất.
Dựa vào các đáp án trên ta thấy H, Na, Ca, Al đều liên kết với Cl ⇒ lớn nhất khi kim loại có độ âm điện nhỏ nhất .
Kim loại Na là kim loại điển hình, có tính kim loại mạnh nhất ⇒ có độ âm điện nhỏ nhất ⇒ Phân tử NaCl có liên kết mang nhiều tính ion nhất.
Câu 8:
20/07/2024Dãy gồm các phân tử đều có liên kết ion là
 Xem đáp án
Xem đáp án
A. Loại vì tất cả đều có liên kết cộng hóa trị.
B. Loại vì HCl, H2S, N2O có liên kết cộng hóa trị.
D. Loại cù H2SO4, H3PO4, HCl có liên kết cộng hóa trị.
Câu 9:
20/07/2024Cho các ion sau: K+, Be2+, Cr3+, F-, Se2-, N3-
Viết phương trình biểu diễn sự hình thành mỗi ion trên Xem đáp án
Xem đáp án
Phương trình biểu diễn sự hình thành các ion:
K → K+ + 1e
Be → Be2+ + 2e
Cr → Cr3+ + 3e
F + e → F-
Se + 2e → Se2-
N + 3e → N3-
Câu 10:
21/07/2024Cho các ion sau: 20Ca2+; 13Al3+; 9F-; 16S2-; 7N3-
a) Viết cấu hình electron của mỗi ion.
b) Mỗi cấu hình đã viết giống với cấu hình electron của nguyên tử nào?
 Xem đáp án
Xem đáp án
a) Cấu hình electron:
20Ca2+: 1s22s22p63s23p6 (I)
12Al3+: 1s22s22p6 (II)
9F-: 1s22s22p6 (III)
16S2-: 1s22s22p63s23p6 (IV)
7N3-: 1s22s22p6 (V)
b) Các cấu hình (II), (III), (V) giống cấu hình electron của khí hiếm 10Ne.
Cấu hình (I), (IV) giống cấu hình electron của khí hiếm 18Ar.
Câu 11:
19/07/2024Vì sao các hợp chất ion thường là chất rắn ở nhiệt độ phòng?
 Xem đáp án
Xem đáp án
Các hợp chất ion thường là chất rắn ở nhiệt độ phòng vì hợp chất ion có cấu trúc mạng tinh thể ion. Lực tĩnh điện mạnh giữa các phần tử mạng với nhau làm cho khoảng cách giữa các phần tử ngắn lại.
Câu 12:
13/07/2024Cho các chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl.
Trong phân tử chất nào có liên kết ion?
 Xem đáp án
Xem đáp án
(K2O) = |0,82 – 3,44| = 2,62 > 1,7
(H2O) = |2,2 – 3,44| = 1,24
(H2S) = |2,2 – 2,58| = 0,38
(SO2) = |2,58 – 3,44| = 0,86
(NaCl) = |0,93 – 3,16| = 2,23 > 1,7
(K2S) = |0,82 – 2,58| = 1,76 > 1,7
(CaF2) = |1 – 3,98| = 2,98 > 1,7
(HCl) = |2,2 – 3,16| = 0,96
Những phân tử có liên kết ion là: K2O, K2S, NaCl, CaF2.
Câu 13:
13/07/2024Kể ra những hợp chất ion tạo thành từ các ion sau: F-, K+, O2-, Ca2+
 Xem đáp án
Xem đáp án
Các hợp chất ion là: KF, K2O, CaF2, CaO.
Câu 14:
21/07/2024Dùng sơ đồ để biểu diễn sự hình thành liên kết trong mỗi hợp chất ion sau đây:
a) magnesium fluoride (MgF2);
b) potassium fluoride (KF);
c) sodium oxide (Na2O);
d) calcium oxide (CaO).
 Xem đáp án
Xem đáp án
a) Magnesium fluoride:
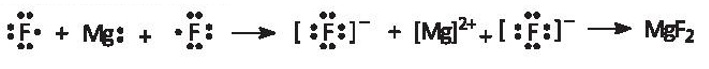
b) Potassium fluoride:
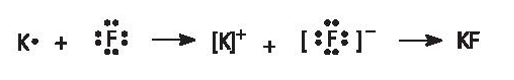
c) Sodium oxide:
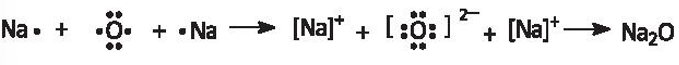
d) Calcium oxide:
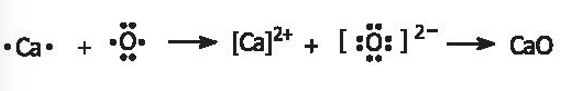
Câu 15:
18/07/2024Anion X- có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim.
b) Giải thích bản chất liên kết giữa X với barium.
 Xem đáp án
Xem đáp án
a) Khi nhận electron, nguyên tử X biến thành anion X-.
Cấu hình electron của X là 1s22s22p63s23p5, X là chlorine.
X có 7 electron lớp ngoài cùng ⇒ X là phi kim điển hình.
b) Barium là nguyên tố kim loại điển hình ở chu kì 6, nhóm IIA. Barium dễ nhường electron hóa trị và tạo ra cation có điện tích 2+. Khi chlorine kết hợp với barium, nguyên tử barium nhường 2 electron cho hai nguyên tử chlorine (mỗi nguyên tử chlorine nhận 1 electron), tạo thành các ion Ba2+ và Cl-.
Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Câu 16:
14/07/2024Nguyên tố X tích lũy trong các tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. Nguyên tử X chỉ có 7 electron trên phân lớp s; còn nguyên tử Z chỉ có 17 electron trên phân lớp p.
a) Viết công thức hóa học của hợp chất tạo bởi X và Z.
b) Hợp chất tạo bởi X và Z có tính dẫn điện không? Vì sao
c) Trong thực tế cuộc sống, hợp chất tạo bởi X và Z được dùng để làm gì?
 Xem đáp án
Xem đáp án
a) Nguyên tử X chỉ có 7 electron trên phân lớp s nên cấu hình electron của X là: 1s22s22p63s23p64s1.
Nguyên tử Z chỉ có 17 e trên phân lớp p nên cấu hình electron của Z là:
1s22s22p63s23p63d104s24p5
⇒ X là 19K và Z là 35Br.
⇒ Công thức hóa học của hợp chất tạo bởi X và Z là KBr.
b) Hợp chất KBr có tính dẫn điện khi nóng chảy hoặc tan trong dung dịch vì nó là hợp chất ion.
c) Trong thực tế, KBr được sử dụng rộng rãi như thuốc chống co giật và an thần, nó là muối ion điển hình, hoàn toàn phân cực và đạt độ pH = 7 trong dung dịch nước.
