Giải SBT Hóa 11 CTST Bài 3: Đơn chất nitroge
Giải SBT Hóa 11 CTST Bài 3: Đơn chất nitroge
-
63 lượt thi
-
10 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
11/07/2024Ở trạng thái tự nhiên, nitrogen
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
Câu 2:
14/07/2024Cấu hình electron nguyên tử của nitrogen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron nguyên tử của nitrogen (Z = 7) là 1s22s22p3.
Câu 4:
17/07/2024Nitrogen trong không khí có vai trò nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nitrogen trong không khí có vai trò cung cấp đạm tự nhiên cho cây trồng.
Câu 5:
12/07/2024a) Tại sao nitrogen là phi kim mạnh lại tồn tại được trong tự nhiên dưới dạng tự do?
 Xem đáp án
Xem đáp án
a) Nitrogen là phi kim mạnh, nhưng đơn chất nitrogen hoạt động hoá học kém ở nhiệt độ thường, tồn tại được trong tự nhiên (khí quyển) vì phân tử N2 có liên kết ba (N ≡ N) rất bền, không thể phân huỷ thành nguyên tử khi ở nhiệt độ thấp hoặc không có xúc tác.
Câu 6:
19/07/2024b) Tại sao nitrogen phản ứng được với nhiều kim loại, nhưng trong vỏ Trái Đất không gặp một nitride (N3-) kim loại nào cả?
 Xem đáp án
Xem đáp án
b) N2 phản ứng với nhiều kim loại (với Li ở nhiệt độ thường và với Ca, Mg khi nóng) tạo ra các nitride kim loại (Li3N, Ca3N2, Mg3N2,...). Khi hình thành Trái Đất, thời kì đầu rất nóng là điều kiện cho nitrogen có thể tạo với một số kim loại mạnh thành những nitride.
Nhưng ở nhiệt độ này hydrogen và oxygen cũng đã hoá hợp với nhau tạo thành nước. Khi có mặt nước, các nitride kim loại đều bị thuỷ phân thành base kiềm và ammonia. Ví dụ:
Ca3N2 + 6H2O → 2NH3 + 3Ca(OH)2
Ammonia tạo ra có thể cháy, nghĩa là bị oxygen của không khí oxi hoá cho trở lại nitrogen:
4NH3 + 3O2 2N2 + 6H2O
Vì các lí do trên nên vỏ Trái Đất không tồn tại các hợp chất nitride.
Câu 7:
11/07/2024Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
 Xem đáp án
Xem đáp án
N2 + 3H2 2NH3
N2 + O2 2NO
Câu 8:
19/07/2024Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định, ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng Kc của phản ứng xảy ra trong bình.
 Xem đáp án
Xem đáp án
Nồng độ của N2 ban đầu là = 1 (M).
Nồng độ của H2 ban đầu là .
N2 (g) + 3H2 (g) 2NH3(g)
Ban đầu: 1 3 (M)
Phản ứng: 0,2 0,6 0,4 (M)
Cân bằng: 0,8 2,4 0,4 (M)
Câu 9:
20/07/2024Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
- Năng lượng liên kết ba N ≡ N là 941 kJ/mol.
- Năng lượng liên kết ba P ≡ P là 490 kJ/mol.
- Năng lượng liên kết đơn N-N là 160 kJ/mol.
- Năng lượng liên kết đơn P-P là 209 kJ/mol.
 Xem đáp án
Xem đáp án
Xét phân tử P4. Phân tử P4 (phosphorus trắng) là một tứ diện trong đó gồm 4 nguyên tử P chiếm 4 đỉnh, liên kết với nhau bằng 6 liên kết đơn P-P
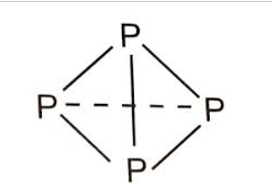
Bốn nguyên tử P kết hợp với nhau để tạo thành phân tử P4 sẽ giải phóng năng lượng là: 6.209 = 1 254 (kJ).
Nếu 4 nguyên tử P kết hợp với nhau để tạo thành 2 phân tử P≡P thì sẽ giải phóng năng lượng là: 2.490 = 980 (kJ).
P hân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
Xét phân tử N2: Tính tương tự như trên, năng lượng được giải phóng khi tạo thành một phân tử N4 từ 4 nguyên tử N là: 6.160 = 960 (kJ).
Năng lượng được giải phóng khi tạo thành 2 phân tử N2 từ bốn nguyên tử N là: 2.941 = 1 882 (kJ).
Phân tử N2 bền hơn N4 ở điều kiện thường.
Câu 10:
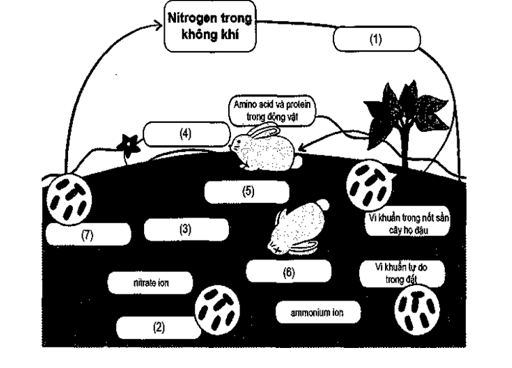
15/07/2024Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn thành chu trình của nitrogen trong tự nhiên.
 Xem đáp án
Xem đáp án
(1) Quá trình cố định đạm.
(2) Quá trình nitrate hoá bởi vi khuẩn.
(3) Quá trình hấp thu đạm của rễ cây.
(4) Động vật sử dụng thức ăn là thực vật.
(5) Động vật chết.
(6) Quá trình phân huỷ xác động vật.
(7) Quá trình khử nitrogen.
