Giải SBT Hóa 10 Bài 4. Cấu trúc lớp vỏ electron của nguyên tử có đáp án
Giải SBT Hóa 10 Bài 4. Cấu trúc lớp vỏ electron của nguyên tử có đáp án
-
91 lượt thi
-
19 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
13/07/2024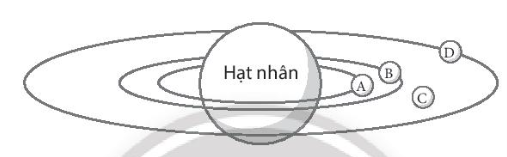
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Theo mô hình nguyên tử Rutherford – Bohr các electron được sắp xếp vào từng lớp do đó tại vị trí C electron không xuất hiện.
Câu 2:
19/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Lớp thứ n có n phân lớp (với n ≤ 4).
Vậy lớp thứ 3 có 3 phân lớp.
Câu 3:
18/07/2024Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Lớp N (n = 4) có 4 phân lớp: 4s; 4p; 4d; 4f. ⇒ A đúng
Lớp M (n = 3) có 3 phân lớp: 3s, 3p, 3d ⇒ B sai.
Số orbital trong lớp thứ n bằng n2 (với n ≤ 4).
⇒ Lớp thứ 4 (lớp N) có 42 = 16 orbital ⇒ C sai
Lớp thứ 3 (lớp M) có 32 = 9 orbital ⇒ D sai.
Câu 4:
20/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
A sai vì lớp K gần hạt nhân nhất.
B sai vì các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
D sai vì lớp N (n = 4) có n2 = 42 = 16 AO.
Câu 5:
22/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Các orbital trong một phân lớp electron có cùng mức năng lượng.
Câu 6:
23/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Phát biểu A sai do lớp M (n = 3) có 3 phân lớp 3s; 3p; 3d.
Câu 7:
21/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Cấu hình electron 1s22s22p63s23p64s24p5 viết sai do thiếu phân lớp 3d.
Câu 8:
19/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử cobalt: 1s22s22p63s23p63d74s2.
Vậy cobalt có 27 electron, số hiệu nguyên tử là 27.
Câu 9:
18/07/2024Nguyên tử Fe có kí hiệu 5626Fe. Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân
(3) Fe là một phi kim
(4) Fe là nguyên tố d
Trong các phát biểu trên, phát biểu đúng là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử Fe: [Ar]3d64s2
Vậy Fe có 2 electron lớp ngoài cùng → (1) sai.
Fe có số neutron = 56 – 26 = 30 → (2) đúng.
Fe là kim loại → (3) sai.
Fe là nguyên tố d → (4) đúng.
Câu 10:
13/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Phát biểu D sai vì X có 5 phân lớp: 1s; 2s; 2p; 3s; 3p.
Câu 11:
19/07/2024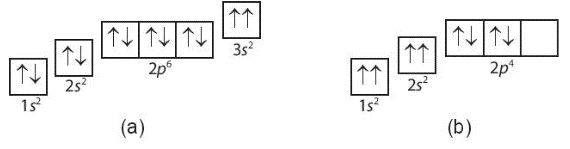
 Xem đáp án
Xem đáp án
Lời giải:
Trường hợp (a) không tuân theo nguyên lí Pauli vì có 2 electron cùng chiều quay trong AO 3s.
Trường hợp (b) không tuân theo nguyên lí Pauli vì có 2 electron cùng chiều quay trong các AO 1s, 2s. Ngoài ra, trường hợp (b) cũng không tuân theo quy tắc Hund vì electron phân bố trên phân lớp 2p chưa đạt được số electron độc thân nhiều nhất.
Câu 12:
16/07/2024 Xem đáp án
Xem đáp án
Lời giải:

Câu 13:
18/07/2024 Xem đáp án
Xem đáp án
Lời giải:
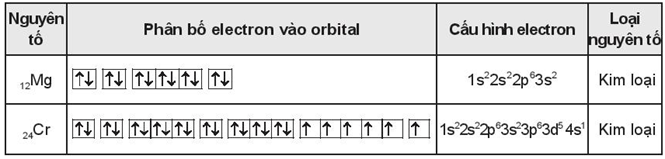
Câu 14:
23/07/2024Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong công việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
- Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s nên cấu hình electron nguyên tử Y là: 1s22s22p63s23p64s1.
Y là kim loại do có 1 electron ở lớp ngoài cùng.
- Nguyên tử X và Y có số electron hơn kém nhau là 3 nên số electron của X là:
19 – 3 = 16.
Cấu hình electron của X: 1s22s22p63s23p4. X là phi kim do có 6 electron ở lớp ngoài cùng.
Câu 15:
22/07/2024 Xem đáp án
Xem đáp án
Lời giải:
X có 3 lớp electron, lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 4 electron.
Số hiệu nguyên tử X là 2 + 8 + 4 = 14. Vậy X là Si (Silicon).
Cấu hình electron của X là: 1s22s22p63s23p2 hay [Ne] 3s23p2.
Câu 16:
21/07/2024X được dùng để làm vỏ phủ vệ tinh nhân tạo hay khí cầu nhằm tăng nhiệt độ nhờ có tính hấp thụ bức xạ điện từ mặt trời khá tốt. Y là một trong những thành phần để điều chế nước Javen tẩy trắng quần áo, vải sợi. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y.
 Xem đáp án
Xem đáp án
Lời giải:
- Nguyên tử nguyên tố X có tổng các electron trong các phân lớp p là 7, nên cấu hình electron nguyên tử X là: 1s22s22p63s23p1 ⇒ ZX = 13, X là Al (Aluminium).
- Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt nên: 2ZY – 2ZX = 8 ⇒ ZY = ZX + 4 = 17, Y là Cl (Chlorine).
Câu 17:
17/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tố có phân lớp d, có 4 lớp electron nên electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dx4s2.
Vậy tổng số electron s và electron p của nguyên tố là: 2 + 2 + 6 + 2 + 6 + 2 = 20.
Câu 18:
19/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tử A có electron ở phân lớp 3d nên phân lớp 4s của A đã bão hòa (với 2 electron). Vậy số electron trên phân lớp 3d của A là 1.
Cấu hình electron nguyên tử A: 1s22s22p63s23p63d14s2.
Câu 19:
21/07/2024 Xem đáp án
Xem đáp án
Lời giải:
- Nguyên tố B có phân lớp cuối là 3p5 nên có cấu hình electron: 1s22s22p63s23p5.
⇒ ZB = 17, B là chlorine (Cl).
- Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1 nên có 3 trường hợp có thể xảy ra:
+ Trường hợp 1: Nguyên tử A không có electron ở 3d. Cấu hình electron của A là: 1s22s22p63s23p64s1 ⇒ ZA = 19, A là potassium (K).
+ Trường hợp 2: Nguyên tử A có phân lớp 3d nửa bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d54s1 ⇒ ZA = 24, A là chromium (Cr).
+ Trường hợp 3: Nguyên tử A có phân lớp 3d bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d104s1 ⇒ ZA = 29, A là copper (Cu).
